题目内容
11.氯有两种稳定的天然同位素37Cl、35Cl,已知它们的原子个数之比为3:1,则氯的相对分之质量为70、72、74的三种氯气分子的物质的量之比为( )| A. | 6:6:1 | B. | 6:3:1 | C. | 3:3:1 | D. | 9:3:1 |
分析 相对分之质量为70、72、74的三种氯气分子分别为35Cl2、35Cl37Cl、37Cl2,而37Cl、35Cl的原子个数之比为3:1,结合选项利用验证法判断.
解答 解:相对分之质量为70、72、74的三种氯气分子分别为35Cl2、35Cl37Cl、37Cl2,而两种同位素的原子个数之比为3:1,
A.若为6:6:1,则37Cl、35Cl的原子个数之比为(2+6):(12+1)=8:13,不符合,故A错误;
B.若为6:3:1,则37Cl、35Cl的原子个数之比为(2+3):(12+3)=1:3,符合,故B正确;
C.若为3:3:1,则37Cl、35Cl的原子个数之比为(2+3):(6+3)=5:9,不符合,故C错误;
D.若为9:3:1,则37Cl、35Cl的原子个数之比为(2+3):(18+3)=5:21,不符合,故D错误.
故选:B.
点评 本题以同位素为载体,考查物质的量有关计算,利用验证法进行计算解答,注意题目中原子数目之比没有指明具体的同位素原子之比.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
20.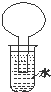 如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的CH4和Cl2,用光照射烧瓶一段时间,下列说法正确的是( )
如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的CH4和Cl2,用光照射烧瓶一段时间,下列说法正确的是( )
 如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的CH4和Cl2,用光照射烧瓶一段时间,下列说法正确的是( )
如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的CH4和Cl2,用光照射烧瓶一段时间,下列说法正确的是( )| A. | 只能生成CH3Cl一种有机物 | B. | 烧瓶内液面不可能上升 | ||
| C. | 大试管内的液体可能会分层 | D. | 向水中加入石蕊试液后无变化 |
2.可以证明可逆反应N2+3H2?2NH3已达平衡状态的是:①一个N≡N键断裂的同时,有3个H-H键断裂;②一个N≡N键断裂的同时,有6个N-H键断裂;③其他条件不变时,混合气体的平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤ω(NH3)、ω(N2)和ω(H2)都不再改变;⑥恒温恒容时,密度保持不变;⑦v正(H2)=0.03mol•L-1•min-1,v逆(NH3)=0.02mol•L-1•min-1( )
| A. | 全部 | B. | ②③④⑤⑥⑦ | C. | ②③④⑤⑦ | D. | 只有③④⑤⑥⑦ |
3.下列说法正确的是( )
| A. | 凡是分子组成相差一个或若干个CH2原子团的物质,彼此一定是同系物 | |
| B. | 分子式为C5H12O且氧化产物能发生银镜反应的醇有6种 | |
| C. | 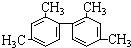 分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 | |
| D. | 1mol β-紫罗兰酮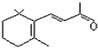 与1mol H2发生加成反应可得到3种不同产物 与1mol H2发生加成反应可得到3种不同产物 |
1.有关蔗糖与浓硫酸的反应,下列说法正确的有( )
| A. | 产生CO2 | B. | 浓硫酸表现出脱水性 | ||
| C. | 放出大量的热 | D. | 浓硫酸表现出还原性 |
 .
.