题目内容
12.下列叙述正确的是( )| A. | K+、ClO‐、SO42‐、HCO3‐一定能共存于 c(Fe3+)=0.1mol•L‐l 的溶液中 | |
| B. | 磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| C. | 在NaClO和NaCl混合溶液中滴入过量SO2气体,反应的离子方程式为:SO2+3C1O‐+H2O═SO42‐+C1‐+2HClO | |
| D. | Na+、HCO3-、Br-、Mg2+可以在 pH=8 的溶液中共存 |
分析 A、铁离子与碳酸氢根离子发生双水解而不能共存;
B、铁离子与碘离子发生氧化还原反应;
C、二氧化硫足量次氯酸根离子完全被还原成氯离子;
D、这几种离子之间不反应.
解答 解:A、铁离子与碳酸氢根离子发生双水解生成氢氧化铁和二氧化碳而不能共存,故A错误;
B、溶液中的碘离子被铁离子氧化成碘单质,溶液中不会存在铁离子,故B错误;
C、二氧化硫足量次氯酸根离子完全被还原成氯离子,所以离子反应方程式为:SO2+C1O‐+H2O═SO42‐+C1‐+2H+,故C错误;
D、这几种离子之间不反应,所以可以大量共存,故D正确;
故选D.
点评 本题考查了离子共存的问题,应注意的是,离子之间若能共存,则必须相互之间不反应.

练习册系列答案
 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
2.能使溴水褪色的是( )
| A. | 乙烯 | B. | 乙烷 | C. | 乙醇 | D. | 乙酸 |
3.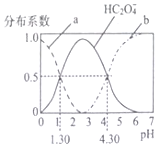 H2C2O4是一种二元弱酸,H2C2O4溶液中各型体浓度在其总浓度中所占比值叫其分布系数,常温下某浓度的H2C2O4溶液中各型体分布系数随pH的变化如图所示,据此分析,下列说法不正确的是( )
H2C2O4是一种二元弱酸,H2C2O4溶液中各型体浓度在其总浓度中所占比值叫其分布系数,常温下某浓度的H2C2O4溶液中各型体分布系数随pH的变化如图所示,据此分析,下列说法不正确的是( )
 H2C2O4是一种二元弱酸,H2C2O4溶液中各型体浓度在其总浓度中所占比值叫其分布系数,常温下某浓度的H2C2O4溶液中各型体分布系数随pH的变化如图所示,据此分析,下列说法不正确的是( )
H2C2O4是一种二元弱酸,H2C2O4溶液中各型体浓度在其总浓度中所占比值叫其分布系数,常温下某浓度的H2C2O4溶液中各型体分布系数随pH的变化如图所示,据此分析,下列说法不正确的是( )| A. | 曲线a代表H2C2O4,曲线b代表C2O42- | |
| B. | 常温下0.1mol/L的NaHC2O4溶液显酸性 | |
| C. | 常温下,H2C2O4的电离平衡常数Ka2=10-4..30 | |
| D. | pH从1.30~4.30时,$\frac{c({H}_{2}{C}_{2}{O}_{4})}{c({C}_{2}{O}_{4}^{2-})}$先增大后减小 |
7.下列实验操作、现象、结论和推理均正确的是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 2mL 0.1mol/L的NaOH溶液中滴加2滴0.1mol/L的MgCl2溶液,再滴加2滴0.1mol/L的FeCl3溶液 | 白色沉淀变为红褐色 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| B | 常温下,质量与表面积均相同的铝片分别投入足量的稀、浓硫酸中 | 浓硫酸中铝片先溶解完 | 反应物浓度越大,反应速率越快 |
| C | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| D | 向Na2SO3溶液加入稀盐酸酸化的Ba(NO3)2溶液 | 产生白色沉淀 | Na2SO3溶液已变质 |
| A. | A | B. | B | C. | C | D. | D |
9.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol•L-1的Ca(ClO)2溶液中含ClO-数目为NA | |
| B. | 标准状况下,22.4L水中含有的分子数为NA | |
| C. | 92g NO2和N2O4混合气体中含有的原子数为6NA | |
| D. | 1.7g H2O2中含有的电子数为0.9NA |
6.X、Y、Z、W是原子序数依次增大的短周期主族元素,X与Z同主族,X原子的最外层电子数是其电子数的$\frac{2}{3}$,Y和W是同一周期中原子半径相差最大两种元素.下列叙述正确的是( )
| A. | 原子半径:W>Z | |
| B. | X、Y 均能与W形成的离子化合物 | |
| C. | Z、W的气态氢化物的稳定性:Z>W | |
| D. | X、Z的最高价氧化物的水化物酸性:X>Z |
7.下列气体中,不能用启普发生器制取的是( )
| A. | 硫化氢 | B. | 二氧化硫 | C. | 二氧化碳 | D. | 氢气 |

