题目内容
13.一定条件下,体积为1L的密闭容器中发生如下反应:SiF4(g)+2H2O(g)?SiO2(s)+4HF(g);△H=+148.9kJ•mol-1(1)下列各项中能说明该反应已达化学平衡状态的是bcd(填字母序号).
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1)所示.
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40 |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
(3)若只改变一个条件使上述反应的化学平衡常数变大,该反应acd(填序号).
a.一定向正反应方向移动
b.一定向逆反应方向移动
c.一定是升高温度造成的
d.SiF4的平衡转化率一定增大.
分析 1)根据化学平衡状态的特征分析,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、质量、体积分数以及百分含量不变,以及由此衍生的一些量也不发生变化,注意选择的物理量应随反应进行发生变化,该物理量由变化到不变,说明到达平衡;
(2)t1时△n(SiF4)=1.2mol-0.8mol=0.4mol,根据方程式可知△n(H2O)=2△n(SiF4)=0.8mol,t2时△n(H2O)=0.8,△n(H2O)=2△n(SiF4)据此计算即可;
(3)平衡常数随温度变化,平衡常数增大,平衡一定正向进行.
解答 解:(1)a、υ消耗(SiF4)=υ生成(HF),都表示正反应速率,且比例关系不等于化学计量数之比,不能说明到达平衡状态,故错误;
b、正反应是气体物质的量增大的反应,随反应进行容器内压强增大,容器内气体压强不再变化说明到达平衡状态,故正确;
c、反应有固体生成,随反应进行气体的总质量减小,容器内气体的总质量不再变化,说明到达平衡状态,故正确;
d、平衡时,各组分的含量不变,HF体积分数不再变化,说明到达平衡状态,故正确;
故答案为:bcd;
(2)由表中数据可知,t1时△n(SiF4)=1.2mol-0.8mol=0.4mol,根据方程式可知△n(H2O)=2△n(SiF4)=0.8mol,故t1时刻,水的物质的量=2.4mol-0.8mol=1.6mol=a,t2时△n(H2O)=0.8,△n(H2O)=2△n(SiF4)=0.8mol,△n(SiF4)=0.4mol,b=0.8mol,故答案为:1.6;0.8;
(3)该反应正反应是吸热反应,使平衡常数增大,平衡向正反应移动,应采取升高温度,SiF4的平衡转化率一定增大,改变压强不影响平衡常数,故adc正确、b错误,
故答案为:acd.
点评 本题考查化学平衡状态判断、化学平衡常数等,难度中等,注意理解化学平衡状态的判断,选择的物理量应随反应进行发生变化,该物理量由变化到不变,说明到达平衡.

| A. | NaCl | B. | H2O | C. | KOH | D. | NaNO3 |
| 实验 | ①将一小块金属钠放入滴有酚酞溶液的冷水中 ②将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液. ③将一小段镁带投入稀盐酸中 ④将一小片铝投入稀盐酸中 |
| 实验 现象 | ①剧烈反应,迅速生成大量的气体. ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红. ③反应不剧烈,产生无色气体. ④有气体产生,溶液变成红色. |
(1)在下表中填写与实验相对应的实验现象序号:
| 实验 | 1 | 2 | 3 | 4 |
| 实验现象 |
(3)实验结论是金属活动性顺序为Na>Mg>Al.
(4)用原子结构理论对上述实验结论进行解释:同周期元素从左至右,原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐减小,原子核对电子的引力逐渐增强,失电子能力逐渐减弱,因此金属性逐渐减弱.
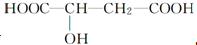 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 苹果酸中能发生酯化反应的官能团有2种 | |
| B. | 1 mol苹果酸可与3 mol NaOH发生中和反应 | |
| C. | 1 mol苹果酸与足量金属Na反应生成1 mol H2 | |
| D. | HOOC-CH2-CH(OH)-COOH与苹果酸互为同分异构体 |
| A. | 变质的油脂有特殊难闻气味,是因为油脂发生了氧化反应 | |
| B. | 棉花的主要成分是淀粉 | |
| C. | 酒精类饮料中含有乙醇 | |
| D. | 牛奶中含有蛋白质 |
| A. | 标准状况下,1 L苯所含有的分子数为$\frac{{N}_{A}}{22.4}$ | |
| B. | 1 mol甲基(-CH3)所含电子数为9NA | |
| C. | 标准状况下,22.4 LC2H4的质量为28克 | |
| D. | 26 g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |
①微粒半径:S2->Cl->S>Cl
②氢化物稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥得电子能力:F>Cl>Br>I.
| A. | ①⑤ | B. | ①③④ | C. | ②④⑥ | D. | ⑥ |
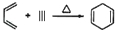 ,如果要合成
,如果要合成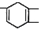 ,所用的起始原料可以是( )
,所用的起始原料可以是( )| A. | CH2=C(CH3)CH=CH2和CH≡C-CH2CH3 | B. | CH2=CHCH=CHCH3和CH3C≡CCH3 | ||
| C. | CH2=C(CH3)C(CH3)=CHCH3和CH≡CH | D. | CH2=C(CH3) C(CH3)=CH2和CH3C≡CH |
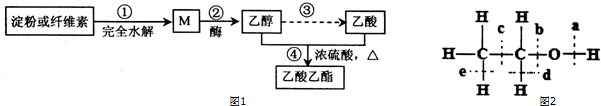
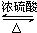 CH3CO18OCH2CH3+H2O.
CH3CO18OCH2CH3+H2O.