题目内容
4.下列不是离子化合物的是( )| A. | NaCl | B. | H2O | C. | KOH | D. | NaNO3 |
分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,含离子键的为离子化合物,以此来解答.
解答 解:A.只含离子键,为离子化合物,故A不选;
B.只含共价键,为共价化合物,故B选;
C.含离子键和O-H共价键,为离子化合物,故C不选;
D.含离子键和N-O共价键,为离子化合物,故D不选;
故选B.
点评 本题考查化学键和物质分类,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.

练习册系列答案
相关题目
14.下列有关胶体的说法正确的是( )
| A. | 胶体不一定是混合物 | |
| B. | 胶体与溶液的本质区别是有丁达尔效应 | |
| C. | 将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体 | |
| D. | 胶体属于介稳体系 |
12.某化学兴趣小组的同学设计了一套实验方案探究元素周期表中元素性质的变化规律:
1.同一周期内从左到右元素金属性的递变规律.
2.同一主族内从上到下元素非金属性的递变规律.
回答下列问题
(1)从上表(Ⅰ)中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写符合要求的答案在空格中(上下必须对应才得分,有几个填几个,不一定把空格填满).
(2)实验结论(用元素符号表示具体的强弱顺序):
元素的金属性:Na>Mg>Al,元素的非金属性:Cl>Br>I
(3)上表(Ⅰ)中实验方法1反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑.
(4)上表(Ⅰ)中实验方法8反应的离子方程式2Al+6H+=2Al3++3H2↑.
(5)上表(Ⅱ)中实验现象F反应的化学方程式Br2+2NaI=2NaBr+I2.
1.同一周期内从左到右元素金属性的递变规律.
2.同一主族内从上到下元素非金属性的递变规律.
| 实验方法(Ⅰ) | 实验现象(Ⅱ) |
| 1.钠与冷水反应,再向反应后溶液中滴 加酚酞. | A.产生白烟 |
| 2.向新制的H2S饱和溶液中滴加新制的氯水 | B.反应不十分剧烈,产生的气体能燃烧,溶液变成浅红色.与酸反应剧烈,产生大量气泡且可以燃烧 |
| 3.镁带用砂纸打磨后在空气中燃烧 | C.产生大量气泡、气体可以燃烧 |
| 4.NaI溶液中加入溴水和CCl4 | D.下层溶液变橙色 |
| 5.镁带用砂纸打磨后与沸水反应,再向反应后溶液中滴加酚酞.镁带用砂纸打磨后与2mol/L盐酸反应. | E.浮于水面,熔成小球,迅速向四处游动,溶液变成红色 |
| 6.蘸浓氨水与浓盐酸的两玻璃棒接近 | F.下层溶液变紫色 |
| 7.NaBr溶液中加入氯水和CCl4 | G.发出耀眼的强光,生成白色物质 |
| 8.铝片用砂纸打磨后与2mol/L盐酸反应 | H.生成淡黄色沉淀 |
(1)从上表(Ⅰ)中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写符合要求的答案在空格中(上下必须对应才得分,有几个填几个,不一定把空格填满).
| 探究同一周期从左到右元素 金属性的递变规律 | 探究同一主族内从上到下元素 非金属性的递变规律 | |||||||
| Ⅰ | ||||||||
| Ⅱ | ||||||||
元素的金属性:Na>Mg>Al,元素的非金属性:Cl>Br>I
(3)上表(Ⅰ)中实验方法1反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑.
(4)上表(Ⅰ)中实验方法8反应的离子方程式2Al+6H+=2Al3++3H2↑.
(5)上表(Ⅱ)中实验现象F反应的化学方程式Br2+2NaI=2NaBr+I2.
19.某元素X的气态氢化物化学式为H2X,则X的最高价氧化物对应的水化物的化学式为( )
| A. | H2XO3 | B. | HXO3 | C. | H3XO4 | D. | H2XO4 |
9.在一定条件下,NO跟NH3可发生反应生成N2和H2O.现有一定量的NO和NH3的混合气体恰好完全反应,所得产物中还原产物比氧化产物多2.8g,则原混合气体中NO和NH3总的物质的量为( )
| A. | 0.25mol | B. | 0.5mol | C. | 1mol | D. | 2mol |
16.已知短周期元素的离子aA2+、bB+、cC2-、dD-都具有相同的电子层结构,则下列叙述中正确的是( )
| A. | 原子序数d>c>b>a | B. | 离子半径C2->D->B+>A2+ | ||
| C. | 原子半径A>B>C>D | D. | 非金属性:C>D |
13.一定条件下,体积为1L的密闭容器中发生如下反应:SiF4(g)+2H2O(g)?SiO2(s)+4HF(g);△H=+148.9kJ•mol-1
(1)下列各项中能说明该反应已达化学平衡状态的是bcd(填字母序号).
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1)所示.
通过计算可得:a=1.6b=0.8.
(3)若只改变一个条件使上述反应的化学平衡常数变大,该反应acd(填序号).
a.一定向正反应方向移动
b.一定向逆反应方向移动
c.一定是升高温度造成的
d.SiF4的平衡转化率一定增大.
(1)下列各项中能说明该反应已达化学平衡状态的是bcd(填字母序号).
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1)所示.
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40 |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
(3)若只改变一个条件使上述反应的化学平衡常数变大,该反应acd(填序号).
a.一定向正反应方向移动
b.一定向逆反应方向移动
c.一定是升高温度造成的
d.SiF4的平衡转化率一定增大.
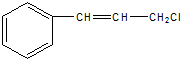 中官能团的名称:碳碳双键、氯原子.
中官能团的名称:碳碳双键、氯原子.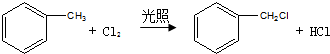 .
.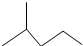 所表示物质的名称是:2-甲基戊烷.
所表示物质的名称是:2-甲基戊烷. (主要产物),1mol某烃A充分燃烧后得到8mol CO2和4mol H2O.
(主要产物),1mol某烃A充分燃烧后得到8mol CO2和4mol H2O.
 .
.
 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaBr
+NaBr +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.