题目内容
10.下列化工生产过程中,未涉及氧化还原反应的是( )| A. | 侯式制碱法制纯碱 | B. | 海带提碘 | ||
| C. | 电解饱和食盐水制烧碱 | D. | 工业上合成氨 |
分析 发生的化学反应中,若存在元素的化合价变化,则属于氧化还原反应,以此来解答.
解答 解:A.侯式制碱法,二氧化碳、氨气、氯化钠反应生成碳酸氢钠和氯化铵,碳酸氢钠受热分解转化为碳酸钠,二氧化碳和水,没有元素的化合价变化,则不涉及氧化还原反应,故A选;
B.海带提碘是由KI变为I2,有元素化合价的变化,属于氧化还原反应,故B不选;
C.氯碱工业中电解食盐水生成氢气、氯气,H、Cl元素的化合价变化,为氧化还原反应,故C不选;
D.工业上合成氨,是氮气与氢气在高温高压催化剂条件下反应生成氨气,有元素化合价的变化,属于氧化还原反应,故D不选;
故选A.
点评 本题考查氧化还原反应,把握发生的化学反应及反应中元素的化合价变化为解答的关键,注意从元素化合价变化角度分析,题目难度不大.

练习册系列答案
相关题目
1.如图甲是利用一种微生物将废水中的尿素(H2NCONH2)的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是( )
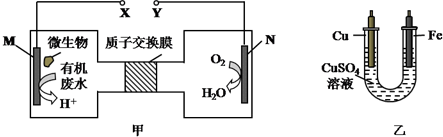

| A. | 乙装置中溶液颜色会变浅 | |
| B. | 铁电极应与Y相连接 | |
| C. | M电极反应式:H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+ | |
| D. | 当N电极消耗0.25mol气体时,则铜电极质量减少16g |
18.下列关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
| A | B | C | D | |
| 强电解质 | C12H22O11 | BaSO4 | NaOH | H3PO4 |
| 弱电解质 | CH3COOH | HF | NH3•H2O | HClO |
| 非电解质 | S | CO2 | 盐酸 | C2H5OH |
| A. | A | B. | B | C. | C | D. | D |
5.磁流体是电子材料的新秀.将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子直径在36~55nm的磁流体.下列说法中正确的是( )
| A. | 所得的分散系属于悬浊液 | |
| B. | 用光束照射该分散系能产生丁达尔效应 | |
| C. | 所得的分散系中分散质为Fe2O3 | |
| D. | 分散系为胶体,胶粒直径即Fe(OH)3分子直径 |
15.某矿石由前20号元素中的4种组成,其化学式为WYZX4.X、Y、Z、W分布在三个周期,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,Y、Z位于同周期,Z单质是一种良好的半导体.下列说法正确的是( )
| A. | 原子半径:W>Y>Z>X | |
| B. | 气态氢化物的稳定性:X<Z | |
| C. | 最高价氧化物对应水化物的碱性:Y>W | |
| D. | Y的氧化物是酸性氧化物 |
2.下列除去杂质的方法正确的是( )
| A. | 除去 CO2中混有的 CO,通入 O2点燃 | |
| B. | 除去铜器表面的铜绿[Cu2 (OH)2CO3]:用盐酸浸泡,再用清水冲洗 | |
| C. | 除去 FeCl3 溶液中的 FeCl2 杂质,加入足量铁粉,再过滤即可 | |
| D. | 除去 Al2O3的 MgO 加入足量的稀盐酸,再过滤即可 |
19.下列实验操作能达到实验目的是( )
| A. | 用排饱和氯化铵溶液的方法收集氨气 | |
| B. | 用重结晶的方法除去BaSO4固体中混有的NaCl | |
| C. | 将碳酸钙置于蒸发皿中高温灼烧可得到氧化钙 | |
| D. | 将硫酸铜溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到胆矾晶体 |
20.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 能使石蕊显红色的溶液:K+、Mg2+、HCO3-、SO42- | |
| B. | 水电离出来的 c(H+)=10-13mol•L-1的溶液:NH4+、Fe2+、NO3-、Cl- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液:K+、Fe3+、Cl-、SO42- | |
| D. | 加入铝片能放出H2的溶液:Na+、CH3COO-、Cu2+、SO42- |
