题目内容
1.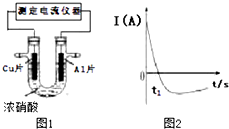 常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,已知0-t1时,原电池的负极是Al片,反应过程中有红棕色气体产生.下列说法不正确的是( )
常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,已知0-t1时,原电池的负极是Al片,反应过程中有红棕色气体产生.下列说法不正确的是( )| A. | 0-t1时,正极的电极反应式为:2H++NO3--e-═NO2+H2O | |
| B. | 0-t1时,溶液中的H+向Cu电极移动 | |
| C. | t1时,负极的电极反应式为:Cu-2e-═Cu2+ | |
| D. | t1时,原电池中电子流动方向发生改变是因为Al在浓硝酸中钝化,氧化膜阻碍了Al的进一步反应 |
分析 0-t1时,Al在浓硝酸中发生钝化过程,Al为负极,氧化得到氧化铝,应有水参加,根据电荷守恒可知,有氢离子生成,Cu为正极,硝酸根放电生成二氧化氮,应由氢离子参与反应,同时有水生成,随着反应进行铝表面钝化形成氧化膜阻碍反应进行,t1时,铜做负极反应,Al为正极.
解答 解:A.0-t1时,原电池的负极是Al片,反应过程中有红棕色气体产生,为正极反应,正极电极反应式为:2H++NO3-+e-=NO2↑+H2O,故A错误;
B.0-t1时,铜为正极,溶液中的H+向Cu电极移动,故B正确;
C.t1时,铜做负极反应,Al为正极,负极发生Cu-2e-=Cu2+,故C正确;
D.随着反应进行铝表面钝化形成氧化膜阻碍反应进行,铜做负极反应,电流方向相反,故D正确.
故选A.
点评 本题考查电解原理,关键是根据电流方向改变理解原电池中正负极转换,理解Al在浓硝酸中发生钝化,属于易错题目,侧重考查学生分析能力,难度较大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
11.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.某温度下,部分含氯组分含量随pH变化情况如图所示,下列说法不正确的是( )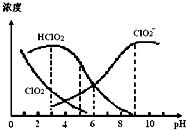

| A. | 使用该漂白剂的适宜pH约为5.0 | |
| B. | 该温度下NaClO2溶液中:c( Na+)>c(ClO2-)>c(OH-)>c(H+) | |
| C. | 该温度下HClO2的电离平衡常数的数值Ka≈1.0×10-6 | |
| D. | 不同pH的NaClO2溶液中存在下列关系:c( Na+)=c(ClO2-)+c(HClO2)+c(ClO2) |
12.下列化合物中与自身类别相同的同分异构体数目(不考虑立体异构)最多的是( )
| A. | 戊烷 | B. | 戊烯 | C. | 乙酸乙酯 | D. | 丁醇 |
9.二氯化二硫(S2C12)分子中的各原子最外层电子数均满足8电子,易与水反应:2S2Cl2+2H2O═4HCl+SO2↑+3S↓.对该反应下列说法正确的是( )
| A. | 1molS2C12价电子数为66NA | |
| B. | 氧化产物与还原产物的物质的量之比为l:7 | |
| C. | 每生成l mol SO2转移4 NA电子 | |
| D. | 每生成48g硫单质会断裂5NA共价键 |
16.下列图示中关于铜电极的连接不正确的是( )
| A. | 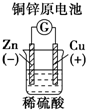 | B. | 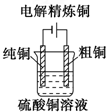 | C. |  | D. |  |
13.下列分子中,所有原子都满足最外层为8电子结构的是( )
| A. | BF3 | B. | PCl5 | C. | NCl3 | D. | CH4 |
10.进行钠与水反应的实验,实验现象归纳表中.为了解释这些现象,请从“供选择的理由”栏中,选择适合的字母代号填入对应的空格中.
| 序号 | 实验现象 | 答案 | 供选择的理由 |
| (1) | 小刀能切割钠块 | C | A有碱(NaOH)生成 B钠密度小于水的密度,钠球表面生成气体(H2)速率不同 C钠硬度较小 D钠的熔点较低,发生放热反应 |
| (2) | 钠溶液化成闪亮的小球 | D | |
| (3) | 钠球浮在水面上,四处游动 | B | |
| (4) | 水中酚酞变红色 | A |
11.下列说法不正确的是( )
| A. | 化学反应是放热还是吸热,取决于生成物和反应物具有的总能量的相对大小 | |
| B. | 吸热反应在常温下不能发生 | |
| C. | 放热反应也可能需要加热才能发生 | |
| D. | 化学反应除了生成新物质外,还伴随着能量的变化 |
 2OH-+H2↑+Cl2↑;.
2OH-+H2↑+Cl2↑;.