题目内容
下列离子方程式与所述事实不相符的是( )
| A、苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | ||
| B、在碳酸氢钠溶液中加入过量的氢氧化钡溶液:Ba2++OH-+HCO3-═BaCO3↓+H2O | ||
C、用新制的氢氧化铜悬浊液检验乙醛中的醛基:CH3CHO+2Cu(OH)2+OH-
| ||
| D、向Ca(ClO)2溶液中通入过量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+2H++Cl-+HClO |
考点:离子方程式的书写
专题:离子反应专题
分析:A.反应生成苯酚和碳酸氢钠;
B.碳酸氢钠完全反应,生成碳酸钡、水、NaOH;
C.发生-CHO的氧化反应生成羧酸盐、氧化亚铜、水;
D.发生氧化还原反应,生成硫酸钙、硫酸、盐酸.
B.碳酸氢钠完全反应,生成碳酸钡、水、NaOH;
C.发生-CHO的氧化反应生成羧酸盐、氧化亚铜、水;
D.发生氧化还原反应,生成硫酸钙、硫酸、盐酸.
解答:
解:A.苯酚钠溶液中通入少量CO2的离子反应为C6H5O-+CO2+H2O→C6H5OH+HCO3-,故A正确;
B.在碳酸氢钠溶液中加入过量的氢氧化钡溶液的离子反应为Ba2++OH-+HCO3-═BaCO3↓+H2O,故B正确;
C.用新制的氢氧化铜悬浊液检验乙醛中的醛基的离子反应为CH3CHO+2Cu(OH)2+OH-
CH3COO-+Cu2O↓+3H2O,故C正确;
D.向Ca(ClO)2溶液中通入过量SO2的离子反应为Ca2++2ClO-+2SO2+2H2O=CaSO4↓+SO42-+4H++2Cl-,故D错误;
故选D.
B.在碳酸氢钠溶液中加入过量的氢氧化钡溶液的离子反应为Ba2++OH-+HCO3-═BaCO3↓+H2O,故B正确;
C.用新制的氢氧化铜悬浊液检验乙醛中的醛基的离子反应为CH3CHO+2Cu(OH)2+OH-
| △ |
D.向Ca(ClO)2溶液中通入过量SO2的离子反应为Ca2++2ClO-+2SO2+2H2O=CaSO4↓+SO42-+4H++2Cl-,故D错误;
故选D.
点评:本题考查离子反应的书写正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应及氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
下列实验中,不会产生沉淀的是( )
| A、CO2通入水玻璃中 |
| B、CO2 通入偏铝酸钠溶液中 |
| C、SO2通入氯化钡溶液中 |
| D、SO2通入氢氧化钙溶液中 |
下列分子或离子之间互为等电子体的是( )
| A、CCl4和PO43- |
| B、NH3和NH4+ |
| C、NO2和CS2 |
| D、CO2和SO2 |
近年来研制的NF3气体可用作氟化氢-氟化氚高能化学激光器的氟源,也可作为火箭推进剂,NF3可用NH3与氟气制取,化学方程式为:4NH3+3F2═NF3+3NH4F,下列说法中不正确的是( )
A、NF3的形成过程用电子式可表示为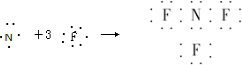 |
| B、NF3的氧化性大于F2 |
| C、NF3分子空间构型为三角锥形 |
| D、NH4F中既有离子键又有极性共价键 |
镁铝合金可用于飞机制造业,主要是利用了它的物理性质中的( )
| A、密度较小 | B、易导电 |
| C、易导热 | D、银白色 |
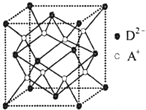 有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数.R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2:1.谙冋答下列问题:
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数.R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2:1.谙冋答下列问题:
 .
.