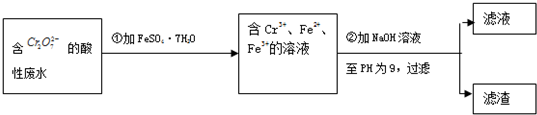
题目内容
 有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数.R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2:1.谙冋答下列问题:
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数.R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2:1.谙冋答下列问题:(1)A元素形成的晶体内晶胞类型应属于
(2)C3-的电子排布式为
(3)C的氢化物在水中的溶解度如何
(4)D元素与同周期相邻元素的第一电离能由大到小的关系是:
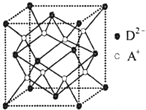
(5)如图所示是R形成的晶体的晶胞,该晶胞与CaF2晶胞结构相似,设晶体密度是ρ g?cm-3.试计算R晶体中A+和D2-最短的距离
(6)已知下列数据:
4Cu(s)+O2(g)═2Cu2O(s)△H=-337.2KJ?mol-1
2Cu (s)+O2(g)═2Cu O(s)△H=-314.6KJ?mol-1
由Cu2O和O2反应生成CuO的热化学方程式是
考点:晶胞的计算,元素电离能、电负性的含义及应用,判断简单分子或离子的构型,原子轨道杂化方式及杂化类型判断,用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化,化学键与晶体结构
分析:B原子得一个电子填入3p轨道后,3p轨道已充满,B为Cl元素;B-离子为Cl-离子,A+比B-少一个电子层,A+为Na+离子;C原子的p轨道中有3个未成对电子,C原子的外围电子排布为ns2np3,是第ⅤA族元素,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,所以为N元素;D的最高化合价和最低化合价的代数和为4,为第ⅥA族元素,最高价氧化物中含D的质量分数为 40%,可推知D的相对原子质量为32,其核内质子数等于中子数,所以质子数为16,D为S元素,A+是Na+离子,D2-离子是S2-离子,R是由Na+离子与S2-离子以2:1形成的离子化合物,R是硫化钠.
解答:
解:B原子得一个电子填入3p轨道后,3p轨道已充满,B为Cl元素;B-离子为Cl-离子,A+比B-少一个电子层,A+为Na+离子;C原子的p轨道中有3个未成对电子,C原子的外围电子排布为ns2np3,是第ⅤA族元素,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,所以为N元素;D的最高化合价和最低化合价的代数和为4,为第ⅥA族元素,最高价氧化物中含D的质量分数为 40%,可推知D的相对原子质量为32,其核内质子数等于中子数,所以质子数为16,D为S元素,A+是Na+离子,R是由Na+离子与D2-离子以2:1形成的离子化合物,D2-离子是S2-离子,R是硫化钠.
(1)钠元素属于A2密堆积式,该晶胞含有2个原子,所以Na元素形成的晶体内晶胞类型应属于体心立方,其空间利用率为68%,
故答案为:体心立方;68%;
(2)N3-核外有10个电子,根据构造原理知,该离子基态核外电子排布式为:ls22s22p6,CB3分子为NCl3分子,N原子有一对孤对电子,与Cl原子成3个δ键,氮原子的杂化方式为sp3,所以CB3分子的VSEPR模型为四面体形,
故答案为:ls22s22p6;sp3;四面体形;
(3)C的氢化物是氨气,一体积水能溶解700体积氨气,氨气分子和水分子之间可以形成氢键,且氨气分子和水分子都是极性分子,根据相似相溶原理知,氨气极易溶于水,
故答案为:1:700溶于水或极易溶于水;氨分子和水分子间可以形成氢键,且氨分子和水分子均为极性分子,相似相溶,氨分子和水分子还可以发生反应,氨气极易溶于水;
(4)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素第一电离能大于相邻元素,所以P、S、Cl元素的第一电离能大小顺序是:Cl>P>S;
同一周期元素中,元素的电负性随着原子序数的增大而增大,一般来说电负性越强,元素的非金属性越强,对应的单质的氧化性越强,如在H2S+Cl2=2HCl+S↓反应中,Cl2的氧化性大于O2的氧化性,
故答案为:Cl>P>S;H2S+Cl2=2HCl+S↓;
(5)该晶胞中钠离子个数=8,氧离子个数=8×
+6×
=4,晶胞的体积=
cm3,晶胞的边长=
cm,四个氧离子和一个钠离子构成正四面体,钠离子位于正四面体的体心上,
四个氧原子位于正四面体的顶点上,钠原子位于体心上,正四面体的棱长=
×
cm,
设氧离子和钠离子的距离为x,
在正三角形BCD中,BE的长=
×
×
cm,BO和OE的长之比为2:1,所以BO的长=
×
×
×
cm,(AO的边长)2=(
×
)2-(
×
×
×
)2,x2=(
×
×
×
)2+(AO的边长-x)2,所以x=
×
cm,
故答案为:
×
;
(6)已知:①4Cu(s)+O2(g)═2Cu2O(s)△H=-337.2kJ?mol-1
②2Cu(s)+O2(g)═2CuO(s)△H=-314.6kJ?mol-1
根据盖斯定律,②×2-①得:2Cu2O(s)+O2(g)=4CuO(s)△H=-292.0kJ?mol-1,
故答案为:2Cu2O(s)+O2(g)=4CuO(s)△H=-292.0kJ?mol-1.
(1)钠元素属于A2密堆积式,该晶胞含有2个原子,所以Na元素形成的晶体内晶胞类型应属于体心立方,其空间利用率为68%,
故答案为:体心立方;68%;
(2)N3-核外有10个电子,根据构造原理知,该离子基态核外电子排布式为:ls22s22p6,CB3分子为NCl3分子,N原子有一对孤对电子,与Cl原子成3个δ键,氮原子的杂化方式为sp3,所以CB3分子的VSEPR模型为四面体形,
故答案为:ls22s22p6;sp3;四面体形;
(3)C的氢化物是氨气,一体积水能溶解700体积氨气,氨气分子和水分子之间可以形成氢键,且氨气分子和水分子都是极性分子,根据相似相溶原理知,氨气极易溶于水,
故答案为:1:700溶于水或极易溶于水;氨分子和水分子间可以形成氢键,且氨分子和水分子均为极性分子,相似相溶,氨分子和水分子还可以发生反应,氨气极易溶于水;
(4)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素第一电离能大于相邻元素,所以P、S、Cl元素的第一电离能大小顺序是:Cl>P>S;
同一周期元素中,元素的电负性随着原子序数的增大而增大,一般来说电负性越强,元素的非金属性越强,对应的单质的氧化性越强,如在H2S+Cl2=2HCl+S↓反应中,Cl2的氧化性大于O2的氧化性,
故答案为:Cl>P>S;H2S+Cl2=2HCl+S↓;
(5)该晶胞中钠离子个数=8,氧离子个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 4×78 |
| ρNA |
| 3 |
| ||

四个氧原子位于正四面体的顶点上,钠原子位于体心上,正四面体的棱长=
| ||
| 2 |
| 3 |
| ||
设氧离子和钠离子的距离为x,
在正三角形BCD中,BE的长=
| ||
| 2 |
| ||
| 2 |
| 3 |
| ||
| 2 |
| 3 |
| ||
| 2 |
| ||
| 2 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||
| 2 |
| 3 |
| ||
| 2 |
| ||
| 2 |
| 3 |
| ||
| 2 |
| 3 |
| ||
| 2 |
| ||
| 2 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||
故答案为:
| ||
| 4 |
| 3 |
| ||
(6)已知:①4Cu(s)+O2(g)═2Cu2O(s)△H=-337.2kJ?mol-1
②2Cu(s)+O2(g)═2CuO(s)△H=-314.6kJ?mol-1
根据盖斯定律,②×2-①得:2Cu2O(s)+O2(g)=4CuO(s)△H=-292.0kJ?mol-1,
故答案为:2Cu2O(s)+O2(g)=4CuO(s)△H=-292.0kJ?mol-1.
点评:本题考查了物质结构和性质,涉及晶胞的计算、元素周期律、氢键等知识点,这些都是学习重点也是学习难点,同时考查学生的空间想象能力及数学应用能力,结合正三角形的性质分析解答,难度较大.

练习册系列答案
相关题目
相同温度下,在体积相同的两个密闭容器内充入等质量的CO2和SO2气体,则下列说法中正确的是( )
| A、CO2和SO2的物质的量相同 |
| B、CO2和SO2的密度比为11:16 |
| C、CO2和SO2的压强比为16:11 |
| D、CO2和SO2中所含氧原子的个数比为1:1 |
根据国家废气排放标准,1m3烟气最高允许含0.4g NOx(可以看作NO和NO2的混合物).
已知:NO+NO2+Na2CO3→2NaNO2+CO2;2NO2+Na2CO3→NaNO2+NaNO3+CO2
现有1m3含2g NOx的烟气用质量分数为0.150的碳酸钠溶液吸收.若吸收率为80%,吸收后的烟气是否符合不符合排放标准( )
已知:NO+NO2+Na2CO3→2NaNO2+CO2;2NO2+Na2CO3→NaNO2+NaNO3+CO2
现有1m3含2g NOx的烟气用质量分数为0.150的碳酸钠溶液吸收.若吸收率为80%,吸收后的烟气是否符合不符合排放标准( )
| A、一定符合 |
| B、一定不符合 |
| C、两种情况都有可能 |
| D、缺条件无法判断 |
下列离子方程式与所述事实不相符的是( )
| A、苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | ||
| B、在碳酸氢钠溶液中加入过量的氢氧化钡溶液:Ba2++OH-+HCO3-═BaCO3↓+H2O | ||
C、用新制的氢氧化铜悬浊液检验乙醛中的醛基:CH3CHO+2Cu(OH)2+OH-
| ||
| D、向Ca(ClO)2溶液中通入过量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+2H++Cl-+HClO |




 有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同.
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同. (Ⅰ)2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.请回答下列问题:
(Ⅰ)2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.请回答下列问题: