��Ŀ����
11���ݱ�����ij��˾�з���һ���ɼ״��������Լ�ǿ�����������Һ�������ֻ���أ����������������غ�﮵�ص�10����������ʹ��1���³��һ�Σ��ٶ��ŵ�����У��״���ȫ����������CO2�������������CO32-�ٸõ�ط�Ӧ�������ӷ���ʽΪ2CH3OH+3O2+4OH-=2CO32-+6H2O
�ڼ״��ڸ���������Ӧ��������������ڷŵ��������Һ��pH����С����������С�����䣩��
����������п�ѧ�������һ�ֹ������ʵ�ȼ�ϵ�أ���Ч�ʸ��ߣ�һ���缫ͨ���������һ�缫ͨ���������������е�����ǹ�̬��������壬��������״̬���ܴ���O2-���ӣ�����������Ӧ������ȫ�����Զ��飨C4H10���������ͣ���֪�õ�صĸ�����ӦʽΪC4H10-26e-+13O2-=4CO2+5H2O���ص�������ӦʽO2+4e-=2O2-��
���� �ŵ�ʱ������ӦΪ��CH3OH-6e-+8OH-=CO32-+6H2O�������缫��Ӧʽ��O2+2H2O+4e-=4OH-����ط�ӦΪ2CH3OH+3O2+4OH-=2CO32-+6H2O���������ʵ�ȼ�ϵ�أ�ͨ������ĵ缫�������õ������������ӣ�
��� �⣺�ٷŵ�����У��״���ȫ����������CO2�������������CO32-����Ӧ���ܷ���ʽΪ2CH3OH+3O2+4OH-=2CO32-+6H2O��
�ʴ�Ϊ��2CH3OH+3O2+4OH-=2CO32-+6H2O��
�ڷŵ�ʱ���״���������ӦΪ��ظ�����Ӧ�����ܷ�Ӧʽ2CH3OH+3O2+4OH-=2CO32-+6H2O����֪����OH-���������ҺpH���ͣ�
�ʴ�Ϊ��������С��
�۹������ʵ�ȼ�ϵ�أ�ͨ������ĵ缫�������õ������������ӣ���缫��ӦΪO2+4e-=2O2-��
�ʴ�Ϊ��O2+4e-=2O2-��
���� �����ۺϿ���ԭ��ع���ԭ������Ŀ�Ѷ��еȣ�ע����������Ϣ��ȷ��д�缫����ʽΪ������Ĺؼ�������ʱע�����缫����ʽ����д��ѧϰ��ע�������д������

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
6����̪����ѧ��ѧ�г��õ����ָʾ������ṹ��ͼ���京�еı���̼ԭ�Ӹ���Ϊ��������


| A�� | 1 | B�� | 2 | C�� | 3 | D�� | 5 |
16���ҹ���ѧ����ӴӴ���ֲ���ȡ�����أ���ѧʽΪC15H22O5�������2015��ŵ��������ѧ����ҽѧ���������ֵ���������������ű����������������ߵ����������й��������ص�������ȷ���ǣ�������
| A�� | ������������ | B�� | �������������� | ||
| C�� | ������������������ | D�� | ����������������� |
3������п�����̵��ң���Ҫ�ɷ�ΪZnO����������Fe2O3��CuO��SiO2��MnO�ȣ�Ϊԭ�Ͽ���������п���壨ZnC2O4•2H2O��

�й��������↑ʼ�����ͳ�����ȫ��pH���±���
���ʴ��������⣺
��1������A����Ҫ�ɷ�ΪSiO2������B����Ҫ�ɷ�ΪFe��OH��3��
��2�����̹����в���MnO��OH��2���������ӷ���ʽΪMn2++H2O2+H2O=MnO��OH��2��+2H+��
��3���ٳ���������Cu2+���ܱ���ȥ��ʱ����ZnO���Ʒ�ӦҺpH�ķ�ΧΪ3.3��5.4��
�����������г������ͭ��˳���ܵߵ�����������ʻ��С����ԭ�����ȼ���ZnS�ὫFe3+��ԭΪFe2+��ʹ��Ԫ�����Գ�ȥ��
��4��������Ҫ��ø��﴿������п���壬����еIJ����ǹ��ˡ�ϴ�ӡ����
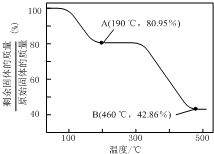
��5��������п������ȷֽ�ɵõ�һ�����ײ��ϣ����ȹ����й�����������¶ȵı仯��ͼ��ʾ��300�桫460�淶Χ�ڣ�������Ӧ�Ļ�ѧ����ʽΪZnC2O4$\frac{\underline{\;��\;}}{\;}$ZnO+CO��+CO2����

�й��������↑ʼ�����ͳ�����ȫ��pH���±���
| �������� | Fe��OH��3 | Fe��OH��2 | Cu��OH��2 | Zn��OH��2 |
| ��ʼ������pH | 1.5 | 6.5 | 4.2 | 5.4 |
| ������ȫ��pH | 3.3 | 9.7 | 6.7 | 8.2 |
��1������A����Ҫ�ɷ�ΪSiO2������B����Ҫ�ɷ�ΪFe��OH��3��
��2�����̹����в���MnO��OH��2���������ӷ���ʽΪMn2++H2O2+H2O=MnO��OH��2��+2H+��
��3���ٳ���������Cu2+���ܱ���ȥ��ʱ����ZnO���Ʒ�ӦҺpH�ķ�ΧΪ3.3��5.4��
�����������г������ͭ��˳���ܵߵ�����������ʻ��С����ԭ�����ȼ���ZnS�ὫFe3+��ԭΪFe2+��ʹ��Ԫ�����Գ�ȥ��
��4��������Ҫ��ø��﴿������п���壬����еIJ����ǹ��ˡ�ϴ�ӡ����
��5��������п������ȷֽ�ɵõ�һ�����ײ��ϣ����ȹ����й�����������¶ȵı仯��ͼ��ʾ��300�桫460�淶Χ�ڣ�������Ӧ�Ļ�ѧ����ʽΪZnC2O4$\frac{\underline{\;��\;}}{\;}$ZnO+CO��+CO2����

20�����������мȺ������Ӽ��ֺ��й��ۼ����ǣ�������
| A�� | Cl2 | B�� | NaCl | C�� | H2O | D�� | NaOH |
1����ѧ��Ӧ���еĿ��������á���ѧ��Ӧ���ʡ�����������ijһ��ѧ��Ӧ�У���Ӧ��B ��Ũ����20s�ڴ�1.0mol•L-1���0.2mol•L-1��������20s����B���ʱ�ʾ�Ļ�ѧ��Ӧ����Ϊ��������
| A�� | 0.08 mol•L-1•s-1 | B�� | 0.04 mol•L-1•s-1 | ||
| C�� | 0.8 mol•L-1•s-1 | D�� | 0.04 mol•L-1 |

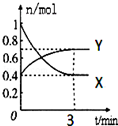 ��һ���¶��£����Ϊ2L���ܱ������У�NO2��N2O4֮�䷢����Ӧ��2NO2��g��������ɫ��?N2O4��g������ɫ������ͼ��ʾ��
��һ���¶��£����Ϊ2L���ܱ������У�NO2��N2O4֮�䷢����Ӧ��2NO2��g��������ɫ��?N2O4��g������ɫ������ͼ��ʾ��