题目内容
13.控制适合的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池.下列判断不正确的是( )
| A. | 为证明反应的发生,可取甲中溶液加入酸性高锰酸钾溶液 | |
| B. | 反应开始时,乙中电极反应为2I--2e-=I2 | |
| C. | 电流计读数为零时,反应达到化学平衡状态 | |
| D. | 反应开始时,甲中石墨电极上Fe3+被还原 |
分析 根据常温下能自动发生的氧化还原反应都可设计成原电池,再利用正反应2Fe3++2I-?2Fe2++I2可知,铁元素的化合价降低,而碘元素的化合价升高,则图中甲烧杯中的石墨作正极,乙烧杯中的石墨作负极,利用负极发生氧化反应,正极发生还原反应,并利用平衡移动来分析解答.
解答 解:A、如果反应甲烧杯中产生还原性的亚铁离子,加入酸性高锰酸钾溶液发生氧化还原反应,紫红褪色,但氯离子也能使酸性高锰酸钾溶液褪色,所以不能说明反应发生,故A错误;
B、乙中发生还原反应,电极反应式为:2I--2e-=I2,故B正确;
C、当电流计为零时,说明没有电子发生转移,则反应达到平衡,故C正确;
D、由总反应方程式知,Fe3+被还原成Fe2+,则发生还原反应,故D正确;
故选A.
点评 本题是对原电池原理综合考查,并注重与化学平衡的联系,学生明确原电池的工作原理、正负极的判断方法、化学平衡的移动即可解答.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
18.一定条件下,向某密闭容器中加入一定量的N2和H2发生可逆反应:N2(g)+3H2(g)?2NH3 (g)测得0s到10s内,C(H2)减小了0.75mol/L,下列说法正确的是( )
| A. | 10s-15sC(NH3)增加量等于0.25 mol/L | |
| B. | 化学反应速率的关系是3v正(H2)=2v正(NH3) | |
| C. | 达到平衡后,分离出少量NH3,平衡正向移动,v正增大 | |
| D. | 保持压强不变充入Ar气体,v正减小 |
3.以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O4•2H2O)

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
请问答下列问题:
(1)滤渣A的主要成分为SiO2,滤渣B的主要成分为Fe(OH)3.
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为Mn2++H2O2+H2O=MnO(OH)2↓+2H+.
(3)①除铁(部分Cu2+可能被除去)时加入ZnO控制反应液pH的范围为3.3~5.4.
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去.
(4)沉淀后要获得干燥纯净草酸锌晶体,需进行的操作是过滤、洗涤、干燥.
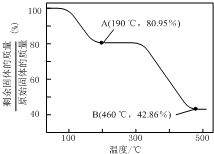
(5)将草酸锌晶体加热分解可得到一种纳米材料.加热过程中固体残留率随温度的变化如图所示,300℃~460℃范围内,发生反应的化学方程式为ZnC2O4$\frac{\underline{\;△\;}}{\;}$ZnO+CO↑+CO2↑.

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
(1)滤渣A的主要成分为SiO2,滤渣B的主要成分为Fe(OH)3.
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为Mn2++H2O2+H2O=MnO(OH)2↓+2H+.
(3)①除铁(部分Cu2+可能被除去)时加入ZnO控制反应液pH的范围为3.3~5.4.
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去.
(4)沉淀后要获得干燥纯净草酸锌晶体,需进行的操作是过滤、洗涤、干燥.
(5)将草酸锌晶体加热分解可得到一种纳米材料.加热过程中固体残留率随温度的变化如图所示,300℃~460℃范围内,发生反应的化学方程式为ZnC2O4$\frac{\underline{\;△\;}}{\;}$ZnO+CO↑+CO2↑.