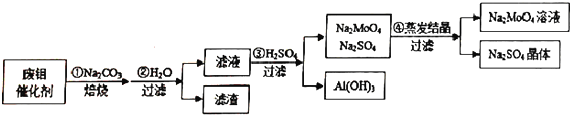
题目内容
2.已知某反应中反应物与生成物有:KIO3、Na2SO3、H2SO4、I3、K2SO4、H2O和未知物X,写出该反应的化学方程式2 KIO3 +5 Na2SO3 +H2SO4 =5 Na2SO4 +I2+K2SO4+H2O.分析 所给物质中存在不同化合价的物质为KIO3、Na2SO3、I2、K2SO4,因还原性Na2SO3>I2,则反应KIO3、Na2SO3为反应物,I2、K2SO4和未知物X为产物,结合质量守恒可知反应的方程式应为2 KIO3 +5 Na2SO3 +H2SO4 =5 Na2SO4 +I2+K2SO4+H2O,则X为Na2SO4,以此解答该题.
解答 解:所给物质中存在不同化合价的物质为KIO3、Na2SO3、I2、K2SO4,因还原性Na2SO3>I2,则反应KIO3、Na2SO3为反应物,I2、K2SO4和未知物X为产物,结合质量守恒可知反应的方程式应为2 KIO3 +5 Na2SO3 +H2SO4 =5 Na2SO4 +I2+K2SO4+H2O,则X为Na2SO4,
故答案为:2 KIO3 +5 Na2SO3 +H2SO4 =5 Na2SO4 +I2+K2SO4+H2O.
点评 本题考查氧化还原反应,明确元素化合价是解本题关键,根据元素化合价变化来分析解答即可,根据得失相等进行配平即可,难度中等.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
12.能形成离子键的是( )
| A. | 任何金属元素与非金属元素之间的化合 | |
| B. | 任意两种元素之间的化合 | |
| C. | 典型活泼金属和典型活泼非金属之间的化合 | |
| D. | 两种非金属元素之间的化合 |
10.下列说法正确的是( )
| A. | 自然界中所有金属都以化合态形式存在 | |
| B. | 化学史上,金、银、铜发现较早,钾、钠、铝发现较迟是因为前者自然界含量高,后者含量低 | |
| C. | 废旧金属处理的最好办法是深埋 | |
| D. | 冶炼金属的一般步骤是:浮选富集→冶炼→精炼 |
17.常温时,下列各组离子能大量共存的是( )
| A. | Cu2+、K+、NO3-、CO32- | B. | Fe3+、NH4+、SO42-、NO3- | ||
| C. | Fe2+、Na+、Cl-、ClO- | D. | H+、Cl-、SO42-、C6H5O- |
7.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 物质的量浓度为1mol/L100mlHCl溶液中含0.1molHCl分子 |
14.填写下面的表格,看是否可以从这些数据中得出有用的结论:
结论:1mol任何原子的质量(以克为单位)在数值上都等于相对原子质量.
| 粒子符号 | 相对分子质量 | 每个粒子的质量(g/个) | 1mol物质含有的粒子数(个) | 1摩尔物质质量(g) |
| C | 12 | 1.993×10-23 | 6.02×1023 | |
| Fe | 56 | 9.302×10-23 | 6.02×1023 | |
| H2O | 18 | 1.628×10-22 | 6.02×1023 | |
| H2SO4 | 98 | 2.990×10-23 | 6.02×1023 | |
| Na+ | 23 | 3.821×10-23 | 6.02×1023 | |
| OH- | 17 | 2.824×10-23 | 6.02×1023 |