题目内容
4.用石墨电极电解硝酸银溶液,在阳极收集到0.32g氧气,中和电解时生成的酸需200mL氢氧化钠溶液,则氢氧化钠溶液的浓度是( )| A. | 0.20 mol/L | B. | 0.15 mol/L | C. | 0.10 mol/L | D. | 0.05 mol/L |
分析 根据电解方程式:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$Ag↓+4HNO3+O2↑,阳极发生4OH--4e-=2H2O+O2↑,根据产生氧气的量计算产生硝酸的量,根据硝酸和氢氧化钠的量之间的关系来计算.
解答 解:用惰性电极电解AgNO3溶液,阳极发生4OH--4e-=2H2O+O2↑,在阳极上收集到0.32克氧气即$\frac{0.32}{32}$=0.01mol氧气(标准状况下),转移电子是0.04mol,根据反应:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$Ag↓+4HNO3+O2↑,生成硝酸是0.04mol,消耗0.04mol氢氧化钠来将之中和,所以NaOH溶液的物质的量浓度为$\frac{0.04mol}{0.2L}$=0.2mol/L,
故选A.
点评 本题考查学生电解池的工作原理以及电池反应的应用和计算,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.已知在25℃、1.0×105Pa条件下,2mol氢气燃烧生成水蒸气放出484KJ热量,下列热化学方程式正确的是( )
| A. | H2(g)+$\frac{1}{2}$ O2(g)═H2O(g)△H=+242 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$ O2(g)═H2O(g)△H=-242kJ/mol | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ/mol |
15.下列化学用语正确的是( )
| A. | 乙烯的结构简式为:CH2CH2 | B. | 苯的分子式为:C6H6 | ||
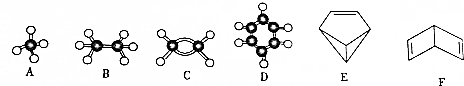
| C. | 四氯化碳的电子式为 | D. | 丙烷分子的比例模型  |
12.在100mL混合酸的溶液中,硝酸的物质的量浓度为0.4mol/L,硫酸的物质的量浓度为0.2mol/L,向其中加入6.4g铜粉,微热,使其充分反应,生成NO的物质的量( )
| A. | 0.067mol | B. | 0.02mol | C. | 0.03mol | D. | 0.04mol |
19.将金属A和金属B分别放入稀H2SO4中均有氢气生成.若将金属A和金属B相连后投入稀H2SO4中发现A被腐蚀,B未被腐蚀.下列叙述正确的是( )
| A. | 金属活动性A>B | |
| B. | 还原性B>A | |
| C. | 在后者装置中金属A发生还原反应,金属B发生氧化反应 | |
| D. | 金属B的表面上明显有气泡产生,金属A表面无明显现象 |
16.0.1mol•L-1的H2S溶液中存在着电离平衡H2S?H++HS-;HS-?S2-+H+.下列叙述中错误的是( )
| A. | 从阴离子HS-电离出H+比从H2S电离出H+更难 | |
| B. | H2S电离出的H+会抑制HS-的电离 | |
| C. | 溶液中c(H+)与c(HS-)接近于相等且c(H+)略大于c(HS-) | |
| D. | 溶液中c(H+)=2c(S2-) |