题目内容
7.下列关于浓硫酸的说法中,不正确的是( )| A. | 常作为气体的干燥剂 | B. | 常温下不能与铁发生反应 | ||
| C. | 滴在蔗糖上,蔗糖会变黑 | D. | 工业上主要采用接触法制备 |
分析 浓硫酸具有酸性、吸水性、脱水性和强氧化性,根据浓硫酸的性质分析解答.
解答 解:A.浓硫酸具有吸水性,所以常作某些气体的干燥剂,故A正确;
B.常温下,铁和浓硫酸发生氧化还原反应而生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,故B错误;
C.浓硫酸具有脱水性,能将蔗糖中的H、O元素以2:1水的形式脱去而将蔗糖转化为碳,故C正确;
D.工业上采用接触法制备硫酸,用浓硫酸吸收三氧化硫生成发烟硫酸,故D正确;
故选B.
点评 本题考查了浓硫酸的性质,知道浓硫酸的三大特性是解本题关键,注意吸水性和脱水性的区别.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
3.以下相关物质的信息都正确的一项是( )
| 选项 | 化学式 | 电子式或含有的化学键类型 | 物质的性质 | 与性质相对应的用途 |
| A | NaClO | 离子键 共价键 | 强氧化性 | 消毒剂 |
| B | H2O2 | 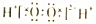 | 不稳定,易分解 | 医用消毒剂 |
| C | NH3 | 共价键 | 水溶液呈弱碱性 | 工业制硝酸 |
| D | NaHCO3 | 离子键 | 受热易分解 | 泡沫灭火器 |
| A. | A | B. | B | C. | C | D. | D |
2.下表是Fe2+、Fe3+、Zn2+被OH-完全沉淀时溶液的pH.某硫酸锌酸性溶液中含有少量Fe2+、Fe3+杂质,为制得纯净的ZnSO4,应加入的试剂是( )
| 金属离子 | Fe2+ | Fe3+ | Zn2+ |
| 完全沉淀时的pH | 7.7 | 4.5 | 6.5 |
| A. | H2O2、ZnO | B. | 氨水 | C. | KMnO4、ZnCO3 | D. | NaOH溶液 |
12.下列变化过程中只放出热量的是( )
| A. | 水结成冰 | B. | 干冰气化 | C. | 食盐溶于水 | D. | 浓硫酸稀释 |
19.在25℃,101kPa下,0.1molC2H2完全燃烧生成CO2和H2O(I)时放出129.96kJ热量.表示上述反应的热化学方程式正确的是( )
| A. | 2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l)+129.96kJ | |
| B. | 2C2H2(g)+5O2(g)→4CO2(g)+2H2O(g)-259.92kJ | |
| C. | 2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l)-1299.6kJ | |
| D. | 2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l)+2599.2kJ |
16.一氧化碳还原氧化铁:Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2,在该反应中( )
| A. | 铁做还原剂 | B. | Fe2O3做氧化剂 | ||
| C. | 铁元素被还原 | D. | 铁元素化合价升高 |
 汽车安全气囊一般由传感器、气囊、气体发生器等组成.
汽车安全气囊一般由传感器、气囊、气体发生器等组成.
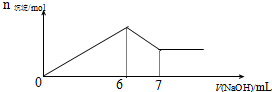 现有AlCl3和MgSO4混合溶液,向其中不断加入0.1mol/L 的NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )
现有AlCl3和MgSO4混合溶液,向其中不断加入0.1mol/L 的NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )