题目内容
下列溶液中呈酸性的是( )
| A、pH=2的CH3COOH和pH=12的NaOH等体积混合 |
| B、pH=3的盐酸和pH=11的氨水等体积混合 |
| C、0.1mol/L的NaCN与0.1mol/L的HCN混合,已知:c(Na+)>c(CN-) |
| D、0.1mol/L的CH3COOH和0.1mol/L的NaOH溶液等体积混合 |
考点:pH的简单计算,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A、pH=2的CH3COOH和pH=12的NaOH等体积混合,得到CH3COOH和CH3COONa的混合物,醋酸的电离为主;
B、pH=3的盐酸和pH=11的氨水等体积混合,得到氨水和氯化铵的混合物,以氨水的电离为主;
C、电荷守恒c(Na+)+c(H+)=c(CN-)+c(OH-),因为c(Na+)>c(CN-),所以c(H+)<c(OH-);
D、0.1mol/L的CH3COOH和0.1mol/L的NaOH溶液等体积混合,两者恰好完全反应,生成单一强碱弱酸盐醋酸钠,水解呈碱性.
B、pH=3的盐酸和pH=11的氨水等体积混合,得到氨水和氯化铵的混合物,以氨水的电离为主;
C、电荷守恒c(Na+)+c(H+)=c(CN-)+c(OH-),因为c(Na+)>c(CN-),所以c(H+)<c(OH-);
D、0.1mol/L的CH3COOH和0.1mol/L的NaOH溶液等体积混合,两者恰好完全反应,生成单一强碱弱酸盐醋酸钠,水解呈碱性.
解答:
解:A、pH=2的CH3COOH和pH=12的NaOH等体积混合,得到CH3COOH和CH3COONa的混合物,醋酸的电离为主,溶液呈酸性,故选;
B、pH=3的盐酸和pH=11的氨水等体积混合,得到氨水和氯化铵的混合物,以氨水的电离为主,溶液呈碱性,故不选;
C、电荷守恒c(Na+)+c(H+)=c(CN-)+c(OH-),因为c(Na+)>c(CN-),所以c(H+)<c(OH-),溶液呈碱性,故不选;
D、0.1mol/L的CH3COOH和0.1mol/L的NaOH溶液等体积混合,两者恰好完全反应,生成单一强碱弱酸盐醋酸钠,水解呈碱性,溶液呈碱性,故不选;
故选A.
B、pH=3的盐酸和pH=11的氨水等体积混合,得到氨水和氯化铵的混合物,以氨水的电离为主,溶液呈碱性,故不选;
C、电荷守恒c(Na+)+c(H+)=c(CN-)+c(OH-),因为c(Na+)>c(CN-),所以c(H+)<c(OH-),溶液呈碱性,故不选;
D、0.1mol/L的CH3COOH和0.1mol/L的NaOH溶液等体积混合,两者恰好完全反应,生成单一强碱弱酸盐醋酸钠,水解呈碱性,溶液呈碱性,故不选;
故选A.
点评:本题考查了溶液酸碱性的判断,明确溶液的酸碱性取决于溶液中c(OH+)、c(H+)的相对大小是解本题的关键,很多同学仅仅根据pH大小判断而导致错误判断,为易错点.

练习册系列答案
相关题目
3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃进行实验,得到的数据如下表:
下列说法不正确的是( )
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol?L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-)/mol?L-1 | 0.040 | 0.040 | 0.080 | c1 | 0.080 |
| t/s | 88.0 | 44.0 | 22.0 | 22.0 | t2 |
| A、该实验的目的是探究I-与S2O82-浓度对反应速率的影响 |
| B、若在40℃下进行编号③对应浓度的实验,显色时间的范围为<22.0s |
| C、实验④c1=0.020 mol?L-1 |
| D、实验⑤显色时间t2=11 s |
在标准状况下,用铂电极电解CuSO4溶液,当阴极产生12.8g铜时,阳极放出的气体是( )
| A、1.12L H2 |
| B、1.12L O2 |
| C、2.24L H2 |
| D、2.24L O2 |
下列反应属于氧化还原反应但不属于置换反应的是( )
| A、NaOH+HCl=NaCl+H2O | ||||
B、C+H2O
| ||||
| C、2Na+2H2O=2NaOH+H2↑ | ||||
| D、2Na2O2+2H2O═4NaOH+O2↑ |
与F-所含质子数与电子数均相等的微粒是( )
| A、OH- |
| B、NH3 |
| C、O2- |
| D、H3O+ |
下列关于含Na元素、C1元素的物质的性质叙述正确的是( )
| A、Na单质在空气中缓慢氧化与燃烧的产物都是Na2O2 |
| B、Na2O与Na2O2都能与水反应,产物相同 |
| C、C12与H2混合光照爆炸,H2在C12也能平静的燃烧 |
| D、C12能与NaOH溶液反应,S单质与NaOH溶液加热也不反应 |
| E、C12能与NaOH溶液反应,S单质与NaOH溶液加热也不反应 |
下列离子方程式正确的是( )
| A、氢氧化铁与盐酸反应:OH-+H+=H2O |
| B、金属钠和水反应:2Na+2H2O=2Na++2OH-+H2↑ |
| C、硫酸溶液中加入氢氧化钡溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| D、向稀硫酸溶液中投入铁粉:2Fe+6H+=2Fe3++3H2↑ |
下列化学用语表达正确的是( )
| A、甲烷的标准燃烧热△H=-890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ?mol-1 |
B、丙烯的键线式: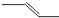 |
| C、一定条件下,某密闭容器中充入2mol SO2(g)和1molO2(g),达到平衡后,放出QkJ热量,则该条件下的热化学方程式为:2SO2(g)+O2(g)?2SO3(g )△H=-Q kJ?mol-1 |
| D、乙烯的结构简式:CH2CH2 |