题目内容
8.乙烯可通过石油裂解获得.下列有关乙烯性质的说法错误的是( )| A. | 在常温常压下为气体 | B. | 不能发生氧化反应 | ||
| C. | 不能自身加成形成聚氯乙烯 | D. | 能使溴的CCl4溶液褪色 |
分析 乙烯含有碳碳双键,可发生加成、加聚和氧化反应,常温下为气体,以此解答该题.
解答 解:A.乙烯相对分子质量较小,分子间作用力较小,常温下为气体,故A正确;
B.含有碳碳双键,可被高锰酸钾氧化,故B错误;
C.可发生加聚反应生成聚乙烯,但不能生成聚氯乙烯,故C正确;
D.乙烯含有碳碳双键,能与溴发生加成反应,能使溴的CCl4溶液褪色,故D正确.
故选B.
点评 本题考查有机物的结构和性质,为高频考点,侧重考查学生的分析能力,注意把握相关物质的结构、性质和用途,难度不大.

练习册系列答案
 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目
19.溶液中可能大量存在的一组离子是( )
| A. | H+、Cl-、PO43-、Na+ | B. | H+、Fe2+、SO42-、NO${\;}_{3}^{-}$ | ||
| C. | K+、H+、NO${\;}_{3}^{-}$、Na+ | D. | OH-、Br-、SO42-、NH4+ |
19.氮氧化物、二氧化硫是造成大气污染的主要物质,某科研小组进行如下研究.
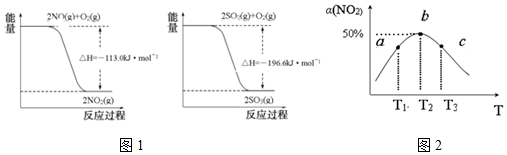
(1)已知:写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式SO2(g)+NO2(g)=SO3(g)+NO(g)△H=-41.8kJ/mol.
(2)向容积为1L密闭容器中分别充入0.10mol NO2和0.15mol SO2,在不同温度下测定同一时刻NO2的转化率,结果如图1所示.
①如图2a、c两点反应速率大小关系:υ(a)<υ(c).(填“>”、“<”或“=”)
②温度为T2时从反应开始经过2min达到b点,用SO3表示这段时间的反应速率为0.025mol•L-1•min-1,此温度下该反应的平衡常数为0.5,若在此温度下,保持容器的容积不变,再向容器中充入0.20mol NO2和0.30mol SO2,NO2的转化率不变.(填“增大”、“减小”或“不变”)
③NO2的转化率随温度升高先增大后减小的原因是:温度为T2,b点为平衡点,T2以前温度升高,反应速率加快,NO2转化率增大,T2以后,该反应为放热反应,升高温度,平衡向逆反应方向移动,转化率减小.
(3)常温下用NaOH溶液吸收SO2,在吸收过程中,溶液pH随n(SO32-):n(HSO3-)变化关系如表:
①当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-).
②当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,在pH为4~7之间电解,硫元素在阴极上被还原为Na2S2O4,这是电化学脱硫技术之一,写出该阴极的电极反应式2HSO3-+2H++2e-=S2O42-+2H2O.

(1)已知:写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式SO2(g)+NO2(g)=SO3(g)+NO(g)△H=-41.8kJ/mol.
(2)向容积为1L密闭容器中分别充入0.10mol NO2和0.15mol SO2,在不同温度下测定同一时刻NO2的转化率,结果如图1所示.
①如图2a、c两点反应速率大小关系:υ(a)<υ(c).(填“>”、“<”或“=”)
②温度为T2时从反应开始经过2min达到b点,用SO3表示这段时间的反应速率为0.025mol•L-1•min-1,此温度下该反应的平衡常数为0.5,若在此温度下,保持容器的容积不变,再向容器中充入0.20mol NO2和0.30mol SO2,NO2的转化率不变.(填“增大”、“减小”或“不变”)
③NO2的转化率随温度升高先增大后减小的原因是:温度为T2,b点为平衡点,T2以前温度升高,反应速率加快,NO2转化率增大,T2以后,该反应为放热反应,升高温度,平衡向逆反应方向移动,转化率减小.
(3)常温下用NaOH溶液吸收SO2,在吸收过程中,溶液pH随n(SO32-):n(HSO3-)变化关系如表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,在pH为4~7之间电解,硫元素在阴极上被还原为Na2S2O4,这是电化学脱硫技术之一,写出该阴极的电极反应式2HSO3-+2H++2e-=S2O42-+2H2O.
3. 1915年诺贝尔物理学奖授予HenryBragg和LawrenceBragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
1915年诺贝尔物理学奖授予HenryBragg和LawrenceBragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如表:
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是MgO>CaO>NaCl>KCl,Na原子核外有4 种不同的能级.
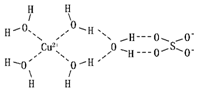
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图,其中配位键和氢键均采用虚线表示.
①实验证明,用蒸汽密度法测得的H2O的相对分子质量比用化学式计算出来的相对分子质量要大,原因是水分子间存在氢键,氢键会使水分子成为缔合水分子,所以计算出来的相对分子质量较大.
②SO42-中S原子的杂化类型是sp3,与其互为等电子体的离子有ClO4-、PO43-(任写两种)
③已知[Cu( NH3)4]2+具有对称的空间构型,[Cu( NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,用[Cu(NH3)4]2+的空间构型为平面正方形
④写出基态Cu2+的外围电子排布式3d9;金属钢采用面心立方堆积方式,已知Cu原子的半径为r pm,NA表示阿伏加徳罗常数,金属铜的密度是$\frac{4×64}{{N}_{A}(2\sqrt{2}r×1{0}^{-10})^{3}}$ g/cm3(列出计算式).
 1915年诺贝尔物理学奖授予HenryBragg和LawrenceBragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
1915年诺贝尔物理学奖授予HenryBragg和LawrenceBragg,以表彰他们用X射线对晶体结构的分析所作的贡献.(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如表:
| 晶体 | NaCl | KC1 | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3401 |
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图,其中配位键和氢键均采用虚线表示.
①实验证明,用蒸汽密度法测得的H2O的相对分子质量比用化学式计算出来的相对分子质量要大,原因是水分子间存在氢键,氢键会使水分子成为缔合水分子,所以计算出来的相对分子质量较大.
②SO42-中S原子的杂化类型是sp3,与其互为等电子体的离子有ClO4-、PO43-(任写两种)
③已知[Cu( NH3)4]2+具有对称的空间构型,[Cu( NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,用[Cu(NH3)4]2+的空间构型为平面正方形
④写出基态Cu2+的外围电子排布式3d9;金属钢采用面心立方堆积方式,已知Cu原子的半径为r pm,NA表示阿伏加徳罗常数,金属铜的密度是$\frac{4×64}{{N}_{A}(2\sqrt{2}r×1{0}^{-10})^{3}}$ g/cm3(列出计算式).
13.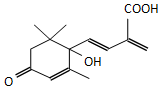 鲜花保鲜剂S-诱抗素制剂,可保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法不正确的是( )
鲜花保鲜剂S-诱抗素制剂,可保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法不正确的是( )
 鲜花保鲜剂S-诱抗素制剂,可保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法不正确的是( )
鲜花保鲜剂S-诱抗素制剂,可保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法不正确的是( )| A. | 其分子式为C14H20O4 | |
| B. | 该物质中含有3种含氧官能团 | |
| C. | 既能发生加成反应,又能发生取代反应 | |
| D. | 既能使紫色石蕊试剂显红色,又能使酸性KMnO4溶液褪色 |
20.常温下,下列说法正确的是( )
| A. | pH=10的CH3COONa溶液中,水电离产生的c(OH-)=1×10-10mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍(溶液体积变为原来10倍)后,其pH=b,则a<b+1 | |
| C. | pH=3的H2S溶液与pH=11的NaOH溶液任意比例混合:C(Na+)+c(H+)=c(OH-)+c(HS-) | |
| D. | pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的:c(Na+)大小顺序为①<②<③ |
17.有一种有机化合物,其结构简式如图,下列有关它的性质的叙述,正确的是( )

| A. | 有弱酸性,1mol该有机物与溴水反应,最多能消耗4mol Br2 | |
| B. | 在一定条件下,1mol该物质最多能与7mol NaOH完全反应 | |
| C. | 在Ni催化下,1mol该物质可以和8mol H2发生加成反应 | |
| D. | 它能发生水解反应,水解后只能生成两种产物 |
18.下列关于元素周期表的描述正确的是( )
| A. | 有7个周期,18个族 | |
| B. | 第IA族元素也称为碱金属元素 | |
| C. | 元素种类最多的族为第IIIB族 | |
| D. | 第七周期若排满,最多可排50种元素 |
 有机酸种类繁多,广泛分布于中草葯的叶、根、特别是果实中,是有机合成、工农业生产的重要原料,请回答下列有关问题:
有机酸种类繁多,广泛分布于中草葯的叶、根、特别是果实中,是有机合成、工农业生产的重要原料,请回答下列有关问题: