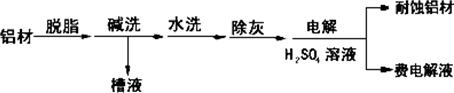
题目内容
6.下列有关物质性质的应用正确的是( )| A. | 次氯酸钙有强氧化性,用于饮用水消毒 | |
| B. | 木炭具有还原性,用于制冰箱除味剂 | |
| C. | 氧化铝具有两性,用于工业冶炼铝单质 | |
| D. | 氯化铁溶液呈酸性,用于蚀刻铜电路板 |
分析 A.具有强氧化性可杀菌消毒;
B.木炭具有吸附性;
C.Al为活泼金属,利用电解法冶炼;
D.Cu与氯化铁发生氧化还原反应.
解答 解:A.具有强氧化性可杀菌消毒,则次氯酸钙有强氧化性,用于饮用水消毒,故A正确;
B.木炭具有吸附性,则用于制冰箱除味剂,与其还原性无关,故B错误;
C.Al为活泼金属,利用电解法冶炼,则工业上电解氧化铝冶炼铝单质,与其两性无关,故C错误;
D.Cu与氯化铁发生氧化还原反应,则用于蚀刻铜电路板,与水解显酸性无关,故D错误;
故选A.
点评 本题考查物质的性质及用途,为高频考点,把握物质的性质、发生的反应、性质与用途的关系为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
16.图是一种分子式为C4H8O2的有机物的红外光谱图,则该有机物可能为( )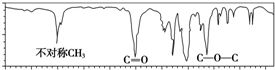

| A. | CH3COOCH2CH3 | B. | CH3CH2COOH | C. | HCOOCH2CH2CH3 | D. | (CH3)2CHCH2COOH |
17.具有以下结构的原子,一定属于主族元素的是( )
| A. | 最外层有1个电子的原子 | B. | 最外层电子排布为ns2的原子 | ||
| C. | 最外层有3个未成对电子的原子 | D. | 次外层无未成对电子的原子 |
1.下列化合物分子中只有σ键的是( )
| A. | CO2 | B. | C2H2 | C. | H2O2 | D. | COCl2 |
11.除去下列物质中的少量杂质(括号内的物质为杂质),所选用的试剂或方法不正确的是( )
| A. | CO2(SO2):饱和NaHCO3溶液 | B. | NO(NO2):水 | ||
| C. | Cl2(HCl):NaOH溶液 | D. | Na2CO3固体(NaHCO3):加热 |
18.在不同温度下,水溶液中c (H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )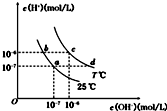

| A. | a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO42- | |
| B. | b点对应的溶液中大量存在:ClO-、Ba2+、OH-、I- | |
| C. | c点对应的溶液中大量存在:Na+、Ba2+、Cl- HCO3- | |
| D. | d点对应的溶液中大量存在:Na+、K+、SO32-、Cl- |
16.历史上发现元素周期律的化学家是( )
| A. | 法拉第(英国) | B. | 凯库勒(德国) | C. | 门捷列夫(俄国) | D. | 道尔顿(英国) |
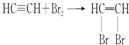
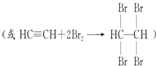 .
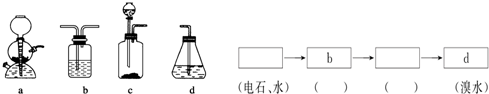
.
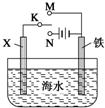 对金属制品进行抗腐蚀处理,可延长其使用寿命.
对金属制品进行抗腐蚀处理,可延长其使用寿命.