题目内容
13.在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的关系如表:| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
②下列各项能说明该反应已达到平衡状态的是c(填字母)
a.单位时间内,消耗1molN2的同时生成2mol NH3 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变.
分析 ①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小;
②可逆反应到达平衡时,同一物质的正、逆反应速率相等,各组分的浓度、含量不变,由此衍生的其它一些物理量不变,注意判断平衡状态的物理量应随反应进行而变化,该物理量由变化到不变化,说明反应到达平衡.
解答 解:①因该反应是放热反应,反应随着温度的升高,平衡逆向移动,故K1>K2,
故答案为:>;
②a.单位时间内,消耗1molN2的同时生成2mol NH3,都体现正反应方向,未体现正与逆的关系,故a错误;
b.不同物质的正、逆反应速率之比等于其计量数之比是平衡状态,故b错误;
c.容器内压强不变,则气体的物质的量不变,该反应达平衡状态,故c正确;
d.如果是在密闭容器中反应,质量不变,体积不变,密度始终不变,故d错误;
故选:c.
点评 本题考查化学平衡产生及其影响因素、平衡状态判断、平衡原理的应用等,侧重对学生分析与应用能力的考查,注意平衡常数及其单位与化学计算量有关,题目难度中等.

练习册系列答案
相关题目
3.下列有关化学用语表示正确的是( )
| A. | 质子数和中子数均为6的碳原子:${\;}_{6}^{6}C$ | |
| B. | 硫离子的结构示意图: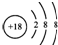 | |
| C. | 氢氧化钠的电子式: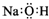 | |
| D. | 2-丙醇的结构简式: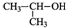 |
4.某高分子化合物的部分结构如图:关于该物质的下列说法中,正确的是( )
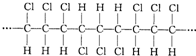

| A. | 合成该聚合物的单体是CHC1=CHC1 | |
| B. | 聚合物的链节(重复的基本结构单元)为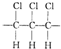 | |
| C. | 聚合物的分子式为C3H3C13 | |
| D. | 该聚合物可表示为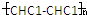 ,其中n为定值 ,其中n为定值 |
1.硅及其化合物在材料领域中应用广泛.下列叙述中,正确的是( )
| A. | 硅酸盐是良好的半导体材料 | B. | 硅是地壳中含量最多的元素 | ||
| C. | SiO2不溶于水,也不溶于任何酸 | D. | 二氧化硅用于制作光导纤维 |
2.亚硝酸在化学反应中既可作氧化剂又可作还原剂,在亚硝酸(HNO2)作氧化剂时,可能生成的产物是( )
①NH3 ②N2 ③N2O3 ④N2O5 ⑤NO2.
①NH3 ②N2 ③N2O3 ④N2O5 ⑤NO2.
| A. | ①和② | B. | ③和④ | C. | ④和⑤ | D. | 只有③ |
3.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 16 g O2中含有的氧分子数为NA | |
| B. | 1 mol Mg变为Mg2+时失去的电子数目为2NA | |
| C. | 常温常压下,11.2 L H2中含有的氢分子数为0.5NA | |
| D. | 1 mol•L-1 CaCl2溶液中含有的氯离子数为NA |