题目内容
下列电离方程式书写正确的是( )
| A、NaHCO3=Na++H++CO32- |
| B、HF?H++F- |
| C、H2CO3?2H++CO32- |
| D、CH3COONH4?CH3COO-+NH4+ |
考点:电离方程式的书写
专题:电离平衡与溶液的pH专题
分析:A.碳酸氢根为多元弱酸的酸式根离子不能拆;
B.氢氟酸为弱电解质,部分电离;
C.碳酸为多元弱酸分步电离,以第一步电离为主;
D.醋酸铵为强电解质,完全电离,用等号.
B.氢氟酸为弱电解质,部分电离;
C.碳酸为多元弱酸分步电离,以第一步电离为主;
D.醋酸铵为强电解质,完全电离,用等号.
解答:
解:A.碳酸氢钠电离的方程式为:NaHCO3=Na++HCO3-,故A错误;
B.氢氟酸电离的方程式为:HF?H++F-,故B正确;
C.碳酸电离方程式为:H2CO3?H++HCO3-,故C错误;
D.醋酸铵电离的方程式为:CH3COONH4=CH3COO-+NH4+,故D错误;
故选:B.
B.氢氟酸电离的方程式为:HF?H++F-,故B正确;
C.碳酸电离方程式为:H2CO3?H++HCO3-,故C错误;
D.醋酸铵电离的方程式为:CH3COONH4=CH3COO-+NH4+,故D错误;
故选:B.
点评:本题考查电离方程式的书写知识,明确电解质的强弱、电离方程式书写的原子是解题的关键,注意碳酸为多元弱酸分步电离,以第一步为主.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
下列变化过程中不能直接实现的是( )
①HCl ②Cl2 ③O2 ④HClO ⑤CO2.
①HCl ②Cl2 ③O2 ④HClO ⑤CO2.
| A、①→② | B、②→④ |
| C、④→③ | D、④→⑤ |
某有机物的结构简式如图,该物质1mol与足量的NaOH溶液反应,消耗NaOH的物质的量为( )
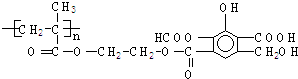
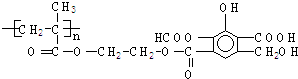
| A、5 mol |
| B、6 mol |
| C、5n mol |
| D、6n mol. |
下列化合物属于苯的同系物的是( )
A、 |
B、 |
C、 |
D、 |
将一定量下列溶液混合后加热蒸干并灼烧,所得固体不可能为纯净物的是( )
| A、FeCl3与FeCl2 |
| B、KHCO3与KOH |
| C、NH4Cl与NaCl |
| D、AlCl3与Al2(SO4)3 |
柠檬烯是一种食用香料,其结构简式如图, 有关柠檬烯的分析不正确的是( )
有关柠檬烯的分析不正确的是( )
 有关柠檬烯的分析不正确的是( )
有关柠檬烯的分析不正确的是( )| A、柠檬烯的核磁图谱中能出现8个峰 |
| B、柠檬烯的同分异构体中属于芳香族的有12种 |
| C、柠檬烯的分子中所有的碳原子不可能在同一个平面上 |
| D、在一定条件下,柠檬烯可以发生加成、氧化、加聚等反应 |
下列说法正确的是( )
| A、1mol CO和1mol N2所含分子数相等,质量相等,它们所占的体积也相等 |
| B、22.4L H2和71g Cl2恰好反应生成2mol HCl |
| C、非标准状况下,1mol气体的体积有可能是22.4L |
| D、1mol HCl和1mol H2O在标准状况下的体积都约是22.4L |
下列表示物质结构的化学用语或模型图正确的是( )
| A、乙醇的分子式:CH3CH2OH | ||
B、二氧化碳的电子式: | ||
C、乙烷的球棍模型 | ||
D、中子数为20的氯原子:
|
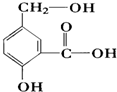 在某有机物A的分子其结构简式如图,请回答.
在某有机物A的分子其结构简式如图,请回答.