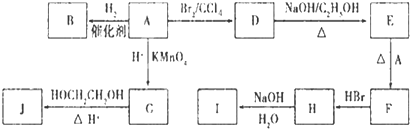
题目内容
 科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°.下列有关N(NO2)3的说法正确的是( )
科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°.下列有关N(NO2)3的说法正确的是( )| A、分子中N、O原子间形成的共价键是非极性键 |
| B、分子中四个氮原子共平面 |
| C、该物质既有氧化性又有还原性 |
| D、分子中四个氮原子围成一个空间正四面体 |
考点:不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:该分子中N-N-N键角都是108.1°,其结构类似于氨气分子,将氨气分子中H原子换为-NO2即可得到该物质分子结构,
A.不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键;
B.该物质分子为三角锥形结构;
C.该分子中的N元素化合价为+5价和-3价;
D.该物质分子为三角锥形结构.
A.不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键;
B.该物质分子为三角锥形结构;
C.该分子中的N元素化合价为+5价和-3价;
D.该物质分子为三角锥形结构.
解答:
解:该分子中N-N-N键角都是108.1°,其结构类似于氨气分子,将氨气分子中H原子换为-NO2即可得到该物质分子结构,
A.不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,所以N、O原子之间形成的共价键是极性键,故A错误;
B.该物质分子为三角锥形结构,所以四个N原子不共面,故B错误;
C.该分子中的N元素化合价为+5价和-3价,所以该物质既有氧化性又有还原性,故C正确;
D.该分子中四个氮原子围成一个空间三角锥形结构,故D错误;
故选C.
A.不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,所以N、O原子之间形成的共价键是极性键,故A错误;
B.该物质分子为三角锥形结构,所以四个N原子不共面,故B错误;
C.该分子中的N元素化合价为+5价和-3价,所以该物质既有氧化性又有还原性,故C正确;
D.该分子中四个氮原子围成一个空间三角锥形结构,故D错误;
故选C.
点评:本题考查分子空间构型、物质的性质、极性键和非极性键等知识点,侧重考查基本理论、基本概念,会根据已知知识采用知识迁移的方法进行分析是解本题关键,注意该物质中N元素化合价判断,为易错点.

练习册系列答案
相关题目
反应3A(g)+B(g)?2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是( )
| A、v (A)=0.15 mol?L-1?s-1 |
| B、v (B)=0.3 mol?L-1?s-1 |
| C、v (C)=0.5 mol?L-1?s-1 |
| D、v(D)=0.4 mol?L-1?s-1 |
维生素C具有的性质错误的是( )
| A、难溶于水 | B、强还原性 |
| C、强氧化性 | D、加热易分解 |
下列热化学方程式中的反应热表示燃烧热的是( )
| A、C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l);△H=-akJ?mol-1 | ||||
B、CH3CH2OH(l)+
| ||||
C、C(s)+
| ||||
D、NH3(g)+
|
K35ClO3晶体与H37Cl浓溶液发生反应生成氯气、氯化钾和水.则此反应生成的氯气的相对分子质量为( )
| A、70.6 | B、73 |
| C、73.3 | D、74 |
下列有关化学用语表示正确的是( )
A、氯离子的结构示意图: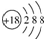 | ||
| B、明矾的化学式:KAl(SO4)2 | ||
C、中子数为10的氧原子:
| ||
D、溴化铵的电子式: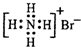 |
下列关于气体摩尔体积的叙述中,正确的是( )
| A、1 mol任何气体的体积都约是22.4 L |
| B、标准状况时,氧气的体积约是22.4 L |
| C、1 molH2和1 molH2O在标准状况下体积都约是22.4 L |
| D、1 mol任何气体在标准状况下所占体积都约是22.4 L |