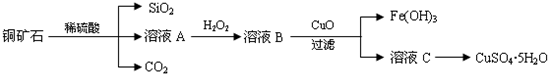
题目内容
3.氮及其化合物在工农业生产和生命活动中起着重要的作用,铵盐、硝酸盐均是植物生长的“食物”,将氮气转化为氮气是植物获得“食物”的第一步,在常温常压下使N2高效地转化成为NH3是众多科学家们一直在探究的问题:(1)已知:①4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-1025kJ•mol-1
②N2(g)+O2(g)?2NO(g)△H=+180.5kJ•mol-1
水的汽化热△H=+44kJ•mol-1
据报道,科学家已找到一种催化剂,使氨气与液态水在常温条件下转化为NH3及氧气,写出反应的热化学方程式2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1650kJ/mol;
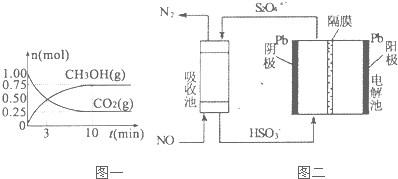
(2)工业时合成氨的原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.图1表示H2的转化率与温度、压强之间的关系,图2表示H2的转化率与起始投料比[n(N2)/n(H2)]、压强的变化关系,则T1、T2、T3的大小关系为T1>T2>T3,曲线与曲线对应的压强P1>P2(填“>”“<”“=”).测得B(X,60)点时N2的转化率为40%,则X=1:2
(3)一定温度下,将2molN2和6molH2置于一密闭容器中反应,测得平衡时容器的总压为aMPa,NH3的物质的量总数为20%,列式计算出此时的平衡常数Kp=$\frac{(0.2aMPa)^{2}}{0.2aMPa×(0.6aMPa)^{3}}$(用平衡分压代替平衡浓度进行计算,分压=总压×体积分数,可不化简).下列各项中能说明反应已达到平衡状态的是a.
a.混合气体的平均相对分子质量不变 b.N2的消耗速率等于NH3的生成速率
c.混合气体的密度不变 d.N2和H2的物质的量之比保持不变
(4)NH3催化剂生成NO,以NO为原料通过电解的方法可以制备NH4NO3,其总反应是8NO+7H2═3NH4NO3+2HNO3,试写出以惰性材料作电极的阴极反应式:NO+6H++5e-=NH4++3H2O.电解过程中为使电解产物全部转化为NH4NO3,需要补充NH3的原因是总反应中有HNO3生成,应补充NH3与HNO3反应生成NH4NO3.

分析 (1)已知:①4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-1025kJ•mol-1
②N2(g)+O2(g)?2NO(g)△H=+180.5kJ•mol-1
水的汽化热△H=+44kJ•mol-1,则可得:③H2O(l)=H2O(g)△H=+44kJ•mol-1,
根据盖斯定律,②×2+③×6-①可得:2N2(g)+6H2O(l)=4NH3(g)+3O2(g);
(2)正反应为放热反应,温度越高,氢气的转化率越低;
正反应为气体物质的量减小的反应,压强越大,氢气的转化率越大;
测得B(X,60)点时N2的转化率为40%,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):a b
变化量(mol):0.4a 1.2a
根据氢气的转化率可得$\frac{1.2a}{b}$=60%,即b=2a,可以计算起始投料比[n(N2)/n(H2)];
(3)一定温度下,将2molN2和6molH2置于一密闭容器中反应,二者氨气1:3反应,故平衡时二者物质的量分数之比为1:3,平衡时NH3的物质的量分数为20%,则N2的物质的量分数为$\frac{1}{4}$×(1-20%)=20%,H2的物质的量分数为1-20%-20%=60%,再计算各物质的分压,代入Kp=$\frac{{P}^{2}(N{H}_{3})}{P({N}_{2})×{P}^{3}({H}_{2})}$计算;
a.混合气体总质量不变,随反应进行混合气体总物质的量减小,则平均相对分子质量减小,混合气体的平均相对分子质量不变,说明反应到达平衡;
b.平衡时NH3的生成速率等于N2的消耗速率的2倍;
c.混合气体总质量不变、容器的容积不变,密度为常数;
d.N2和H2的起始物质的量之比等于化学计量数之比,二者物质的量之比始终为1:3;
(4)NH3催化剂生成NO,以NO为原料通过电解的方法可以制备NH4NO3,其总反应是:8NO+7H2O=3NH4NO3+2HNO3,阴极发生还原反应,阴极上是NO获得电子生成NH4+,由电荷守恒可知有H+参与反应,还生成水,电池总反应中有HNO3生成,应补充NH3与HNO3反应生成NH4NO3.
解答 解:(1)已知:①4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-1025kJ•mol-1
②N2(g)+O2(g)?2NO(g)△H=+180.5kJ•mol-1
水的汽化热△H=+44kJ•mol-1,则可得:③H2O(l)=H2O(g)△H=+44kJ•mol-1,
根据盖斯定律,②×2+③×6-①可得:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1650kJ/mol,
故答案为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1650kJ/mol;
(2)正反应为放热反应,温度越高,氢气的转化率越低,则T1>T2>T3;
正反应为气体物质的量减小的反应,压强越大,氢气的转化率越大,则:P1>P2;
测得B(X,60)点时N2的转化率为40%,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):a b
变化量(mol):0.4a 1.2a
根据氢气的转化率可得$\frac{1.2a}{b}$=60%,即b=2a,则X=$\frac{a}{b}$=$\frac{a}{2a}$=1:2,
故答案为:T1>T2>T3;1:2;
(3)一定温度下,将2molN2和6molH2置于一密闭容器中反应,二者氨气1:3反应,故平衡时二者物质的量分数之比为1:3,平衡时NH3的物质的量分数为20%,则N2的物质的量分数为$\frac{1}{4}$×(1-20%)=20%,H2的物质的量分数为1-20%-20%=60%,平衡时容器总压为aMPa,则Kp=$\frac{{P}^{2}(N{H}_{3})}{P({N}_{2})×{P}^{3}({H}_{2})}$=$\frac{(0.2aMPa)^{2}}{0.2aMPa×(0.6aMPa)^{3}}$;
a.混合气体总质量不变,随反应进行混合气体总物质的量减小,则平均相对分子质量减小,混合气体的平均相对分子质量不变,说明反应到达平衡,故a正确;
b.平衡时NH3的生成速率等于N2的消耗速率的2倍,故b错误;
c.混合气体总质量不变、容器的容积不变,密度始终不变,故c错误;
d.N2和H2的起始物质的量之比等于化学计量数之比,二者物质的量之比始终为1:3,故d错误,
故答案为:$\frac{(0.2aMPa)^{2}}{0.2aMPa×(0.6aMPa)^{3}}$;a;
(4)NH3催化剂生成NO,以NO为原料通过电解的方法可以制备NH4NO3,其总反应是:8NO+7H2O=3NH4NO3+2HNO3,阴极发生还原反应,阴极上是NO获得电子生成NH4+,由电荷守恒可知有H+参与反应,还生成水,电极反应式为:NO+6H++5e-=NH4++3H2O,电池总反应中有HNO3生成,应补充NH3与HNO3反应生成NH4NO3,
故答案为:NO+6H++5e-=NH4++3H2O;总反应中有HNO3生成,应补充NH3与HNO3反应生成NH4NO3.
点评 本题考查化学平衡计算、化学平衡影响因素、平衡状态判断、热化学方程式书写、电解原理等,是对学生综合能力的考查,难度中等.

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案| A. | 生成物总能量一定低于反应物总能量 | |
| B. | 酒精可用作燃料,说明酒精燃烧是释放能量的反应 | |
| C. | 干冰气化需要吸收大量的热,这个变化是吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
Ⅰ.已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1
N2(g)+2O2(g)=2NO2(g)△H2
H2O(l)=H2O(g)△H3
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=△H1-△H2+2△H3(用△H1、△H2、△H3)
Ⅱ.在温度为T1℃和T2℃时,分别将0.50molCH4和1.2molNO2充入体积固定的2L密闭容器中,发生上述可逆反应,测得不同时刻的n(CH4)数据如下表:
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1℃ | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2℃ | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 | 0.15 |
A.T1℃、前10min,V(NO2)=0.03mol/(L•min)
B.T1℃、反应达化学平衡状态时,CH4的转化率为80%
C.T2℃、反应在40min时处于平衡状态
D.T1>T2
(2)反应的平衡常数K(T1)>K(T2),△H<0,理由是由表中数据可知,T2时反应速率较大,所以T1<T2;升高温度平衡逆向移动,可知K(T1)>K(T2),所以正反应放热.
(3)T1℃时反应的平衡常数K为3.2.
(4)反应在T1℃下进行,50min时,向平衡后的容器中再通入0.10molCH4和0.40molNO2,在下图中画出恒温,重新达到平衡过程中n(CH4)随时间变化的曲线(只要求画出n(CH4)的变化趋势,不需要准确画出再次平衡后n(CH4).
Ⅲ.NO2、O2和熔融NaNO3可制作燃料电池,其原理见下图.该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,其电极反应式为NO2-e-+NO3-=N2O5.

| A. | HCN | B. | CH3COOH | C. | HF | D. | HNO2 |
| A. | 0.2 mol•L-1氨水中,c(OH-)与c(NH4+)相等 | |
| B. | 0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | pH=3的一元酸和pH=11的一元碱等体积混和后的溶液中一定是c(OH-)=c(H+) | |
| D. | 10mL0.02mol•L-1HCl溶液与10mL0.02mol•L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 |
①I2(g)+H2(g)?2HI(g)△H=-9.48kJ/mol
②I2(s)+H2(g)?2HI(g)△H=+26.48kJ/mol.
| A. | 254gI2(g)中通入2gH2(g),反应放热9.48kJ | |
| B. | 当反应②吸收52.96kJ热量时转移2mole- | |
| C. | 反应②的反应物总能量比反应①的反应物总能量低 | |
| D. | 1mol固态碘与1mol气态碘多了17.00kJ能量 |
| A. | 1.00 mol NaCl 中含有 6.02×1023个分子 | |
| B. | 1.00 mol NaCl 中,所有Na+的电子总数为 10×6.02×1023 | |
| C. | 欲配制 1.00 L 1.00 mol/L 的NaCl溶液,可将 58.5gNaCl溶于 1.00L 水中 | |
| D. | 电解 58.5g 熔融的 NaCl,能产生22.4L氯气(标准状况)、23.0g 金属钠 |