题目内容
13.下列叙述正确的是( )| A. | 1.00 mol NaCl 中含有 6.02×1023个分子 | |
| B. | 1.00 mol NaCl 中,所有Na+的电子总数为 10×6.02×1023 | |
| C. | 欲配制 1.00 L 1.00 mol/L 的NaCl溶液,可将 58.5gNaCl溶于 1.00L 水中 | |
| D. | 电解 58.5g 熔融的 NaCl,能产生22.4L氯气(标准状况)、23.0g 金属钠 |
分析 A.氯化钠为离子化合物,不含分子;
B.Na+的电子数为10;
C.58.5gNaCl 溶于 1.00L 水中,溶液体积大于1L;
D.n(NaCl)=1mol,生成0.5mol氯气.
解答 解:A.氯化钠为离子化合物,不含分子,故A错误;
B.Na+的电子数为10,则1.00 mol NaCl 中,Na+的物质的量为1.00mol,电子总数为 10×6.02×1023,故B正确;
C.58.5gNaCl 溶于 1.00L 水中,溶液体积大于1L,则浓度小于1.00 mol/L,故C错误;
D.n(NaCl)=$\frac{58.5g}{58.5g/mol}$=1mol,生成0.5mol氯气,体积为11.2L,故D错误.
故选B.
点评 本题综合考查物质的量的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握相关计算公式的运用,易错点为A,注意离子化合物与共价化合物的区别,难度不大.

练习册系列答案
相关题目
8.下列各选项中,前者属于电解质,后者属于非电解质的是( )
| A. | NaOH、氯气 | B. | 盐酸、蔗糖 | C. | 熔融NaCl、酒精 | D. | 二氧化碳、BaSO4 |
18.打破“生命力论”的科学家是( )
| A. | 道尔顿 | B. | 贝采利乌斯 | C. | 维勒 | D. | 爱因斯坦 |
5.下列应用或事实与胶体的性质没有关系的是( )
| A. | 使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血 | |
| B. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀 | |
| C. | 清晨的阳光穿过茂密的林木枝叶所产生的美丽景象(光线) | |
| D. | 用石膏或盐卤点制豆腐 |
2.下列实验操作中错误的是( )
| A. | 蒸发操作时,不能使混合物中的水分完全蒸干后才停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
3.下列离子方程式正确的是( )
| A. | 0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| B. | FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2═2Fe3++2H2O | |
| C. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 电解MgCl2水溶液的离子方程式:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- |

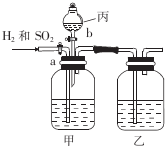 为了分离H2和SO2,并分别得到干燥的气体,某学生设计了一个实验装置.(a、b为活塞,且每个装置中的溶液均过量)
为了分离H2和SO2,并分别得到干燥的气体,某学生设计了一个实验装置.(a、b为活塞,且每个装置中的溶液均过量)