题目内容
2.下列离子组在指定溶液中能大量共存的是( )| A. | 常温下,c(H+)/c(OH一)=1×10-12的溶液:K+、AlO2-、SiO32-、Na+ | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入石蕊显蓝色的溶液:Cu2+、Al3+、NO3-、SO42- | |
| D. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- |
分析 A.常温下,c(H+)/c(OH一)=1×10-12的溶液呈碱性;
B.加入KSCN显红色的溶液含有Fe3+;
C.加入石蕊显蓝色的溶液呈碱性;
D.加入Al能放出大量H2的溶液可能呈酸性或碱性.
解答 解:A.常温下,c(H+)/c(OH一)=1×10-12的溶液呈碱性,碱性条件下离子之间不发生任何反应,可大量共存,故A正确;
B.加入KSCN显红色的溶液含有Fe3+,具有氧化性,I-不能大量共存,故B错误;
C.加入石蕊显蓝色的溶液呈碱性,Cu2+、Al3+不能大量共存,故C错误;
D.加入Al能放出大量H2的溶液可能呈酸性或碱性,酸性条件下Fe2+、NO3-发生氧化还原反应而不能大量共存,碱性条件下NH4+、Fe2+不能大量共存,故D错误.
故选A.
点评 本题考查了离子共存,为考试热点,明确离子共存条件是解本题关键,再结合题中限制性条件来分析解答即可,注意把握常见离子的性质,难度不大.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
17.下列物质不可能由醛与氢气发生加成反应得到的是( )
| A. |  | B. | CH3-CH2-CH2-CH2OH | ||
| C. |  | D. |  |
7.下列实验操作先后顺序正确的是( )
| A. | 先装好药品,再检查装置的气密性 | |
| B. | 先用双手握紧试管,再将导管插入水中检查装置气密性 | |
| C. | 结束氢气还原氧化铜的实验时,先熄灭酒精灯后撤出导管 | |
| D. | 稀释硫酸时,先在烧杯里倒入浓硫酸,再小心倒入水并不断搅拌 |
14.表是A、B、C、D、E五种有机物的有关信息:
根据表中信息回答下列问题:
(1)A与水在一定条件下反应生成的物质C是乙醇(填名称);写出在一定条件下,A生成高分子化合物的化学方程式:nCH2=CH2$\stackrel{催化剂}{→}$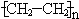 .
.
(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大
⑤任何条件下不与氢气反应 ⑥可使酸性高锰酸钾溶液和溴水均褪色
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: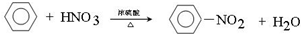 .
.
(4)写出由C氧化生成D的化学方程式:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(5)C与E反应能生成相对分子质量为100的酯,该反应类型为取代(酯化)反应;其化学方程式为:CH2=CH-COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH2=CH-COOC2H5+H2O.
| A | B | C | D | E |
| ①能使溴水褪色 ②比例模型为  ③能与水在一定条件下反应生成物质C | ①由C、H两 种元素组成 ②球棍模型为 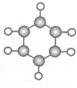 | ①由C、H、O三种元素组成 ②能与Na反应,但不能与NaOH溶液反应 ③能与E反应生成相对分子质量为100的酯 | ①相对分子质量 比物质C小2②能由物质C氧化而成 | ①由C、H、O三种元素组成 ②球棍模型为  |
(1)A与水在一定条件下反应生成的物质C是乙醇(填名称);写出在一定条件下,A生成高分子化合物的化学方程式:nCH2=CH2$\stackrel{催化剂}{→}$
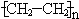 .
.(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大
⑤任何条件下不与氢气反应 ⑥可使酸性高锰酸钾溶液和溴水均褪色
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 .
.(4)写出由C氧化生成D的化学方程式:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(5)C与E反应能生成相对分子质量为100的酯,该反应类型为取代(酯化)反应;其化学方程式为:CH2=CH-COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH2=CH-COOC2H5+H2O.
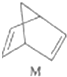 $?_{暗处}^{光照}$
$?_{暗处}^{光照}$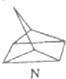 △H═88.6kJ•mol-1
△H═88.6kJ•mol-1