题目内容
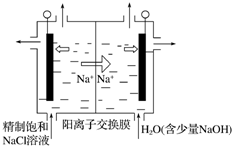
17.在NaOH溶液中加入盐酸,至恰好完全反应,反应的微观示意图见如图.下列有关认识错误的是( )
| A. | 反应结束时溶液的pH=7 | |
| B. | 反应后溶液中存在的粒子只有Na+和Cl- | |
| C. | 该反应的实质是H+和OH-结合生成水 | |
| D. | 反应前后所有元素的化合价均无变化 |
分析 氢氧化钠溶液中含有Na+、OH-和H2O,盐酸中含有H+、Cl-和H2O,氢氧化钠和盐酸的反应为中和反应,反应的实质是酸中的H+和碱中的OH-结合生成了水分子,以此解答该题.
解答 解:A.酸碱中和生成盐和水,反应后溶液中的H+和OH-没有剩余,溶液呈中性,pH=7,故A正确;
B.反应后溶液中存在的粒子有Na+和Cl-和H2O,故B错误;
C.氢氧化钠和盐酸的反应为中和反应,反应的实质是酸中的氢离子和碱中的氢氧根离子结合生成了水分子,故C正确;
D.由于氢氧化钠与盐酸反应生成盐和水,属于复分解反应,复分解反应前后各种元素化合价不变,故D正确.
故选B.
点评 本题主要从微观粒子角度考查了中和反应的概念以及质量守恒定律的微观解释,为高频考点,侧重于学生的分析能力的考查,注意把握化学反应的特点,需要同学们深入理解微观粒子的运动,难度不大.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
7.下列实验操作先后顺序正确的是( )
| A. | 先装好药品,再检查装置的气密性 | |
| B. | 先用双手握紧试管,再将导管插入水中检查装置气密性 | |
| C. | 结束氢气还原氧化铜的实验时,先熄灭酒精灯后撤出导管 | |
| D. | 稀释硫酸时,先在烧杯里倒入浓硫酸,再小心倒入水并不断搅拌 |
8.常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
①2Fe2++H2O2+2H+=2Fe3++2H2O
②2Fe3++H2O2=2Fe2++O2↑+2H+
下列说法不正确的是( )
①2Fe2++H2O2+2H+=2Fe3++2H2O
②2Fe3++H2O2=2Fe2++O2↑+2H+
下列说法不正确的是( )
| A. | H2O2在反应①中作氧化剂,在反应②中作还原剂 | |
| B. | 在H2O2分解过程中,溶液的pH逐渐减小 | |
| C. | 在H2O2分解过程中,Fe2+起到催化剂的作用 | |
| D. | H2O2生产过程要严格避免混入Fe2+ |
2.设NA为阿伏伽德罗常数值.下列有关叙述正确的是( )
| A. | 14g乙烯和丙烯混合气体中的原子数为2NA | |
| B. | 1molN2与4molH2反应生成的NH3分子数为2NA | |
| C. | 1molFe溶于过量硝酸,电子转移数为3NA | |
| D. | 标准状况下,2.24LCCl4含有的共价键数为0.4NA |
9.下列解释事实的方程式不正确的是( )
| A. | 向饱和CaCl2溶液中通入少量的CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 用Fe2(SO4)3做净水剂:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| C. | 水垢中的CaSO4用Na2CO3溶液处理:CaSO4+CO32-═CaCO3+SO42- | |
| D. | 向5 mL 0.1 mol•L-1的K2Cr2O7溶液中滴加5滴浓硫酸,溶液橙色变深:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+ |
7.若20g密度为ρg•cm-3的硝酸钙溶液里含1g Ca2+,则NO3-的物质的量浓度是( )
| A. | ρ400mol•L-1 | B. | 20ρmol•L-1 | C. | 2.5ρmol•L-1 | D. | 1.25ρmol•L-1 |
 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.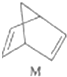 $?_{暗处}^{光照}$
$?_{暗处}^{光照}$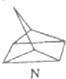 △H═88.6kJ•mol-1
△H═88.6kJ•mol-1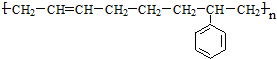

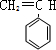 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$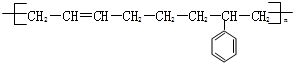 .
.