题目内容
现有甲烷和氧气的混合气体,测得在标准状况下的密度为1.25g/L,求这混合气体中甲烷和氧气的质量比为多少?
考点:有关混合物反应的计算
专题:计算题
分析:根据M=ρVm计算混合气体平均摩尔质量,令甲烷和氧气的物质的量分别为xmol、ymol,根据平均摩尔质量列方程计算甲烷和氧气的物质的量之比,再根据m=nM计算二者质量之比.
解答:
解:标况下,甲烷和氧气混合气体的密度为1.25g/L,则平均摩尔质量为1.25g/L×22.4L/mol=28g/mol,令甲烷和氧气的物质的量分别为xmol、ymol,则:
=28,整理得x:y=1:3,故混合气体中甲烷和氧气的质量比为1mol×16g/mol:3mol×32g/mol=1:6,
答:混合气体中甲烷和氧气的质量比为1:6.
| 16x+32y |
| x+y |
答:混合气体中甲烷和氧气的质量比为1:6.
点评:本题考查混合物计算,侧重考查物质的量有关计算,难度不大,注意掌握以物质的量为中心的计算公式.

练习册系列答案
相关题目
下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A、碱 纯碱 Na2CO3 |
| B、酸 硫酸 H2S |
| C、酸性氧化物 干冰 CO2 |
| D、盐 碳铵 (NH4)2CO3 |
化学与工农业生产、环境保护、日常生活等方面有广泛联系,下列叙述错误的是( )
| A、绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 |
| B、“84”消毒液的有效成分为NaClO,能杀菌消毒 |
| C、某雨水放置一段时间后,pH由4.68变为4.28,是因为雨水在放置过程中溶解了较多的CO2 |
| D、高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
电解下列哪种物质的水溶液相当于电解水的是( )
| A、H2SO4 |
| B、NaCl |
| C、CuSO4 |
| D、HCl |
丁烷、甲烷、乙醛的混合气体在同温同压下与二氧化碳的密度相同,已知其中丁烷占总体积的25%,那末三种气体的体积比是( )
| A、1:2:5 |
| B、5:2:1 |
| C、2:1:5 |
| D、2:5:1 |
有一在空气中暴露过的KOH固体,经分析测知含H2O3.12%,K2CO36%,其余为KOH.取此样品m g溶于100g 98%的硫酸里,残酸需加 n g KOH才刚好中和完全.由此可知蒸发中和后的溶液可得到多少克固体?( )
| A、14.2mg | ||
| B、174g | ||
C、
| ||
| D、无法计算 |
下列实验设计方案中,可行的是( )
| A、向某无色溶液中仅加入AgNO3溶液,以检验未知溶液中的Cl- | ||
| B、用洗气瓶中的NaOH溶液除去CO2气体中混有的HCl气体 | ||
C、向某无色溶液中仅加入BaCl2溶液,以检验未知溶液中的SO
| ||
| D、用加入适量铜粉的方法除去Cu(NO3)2溶液中的AgNO3杂质 |
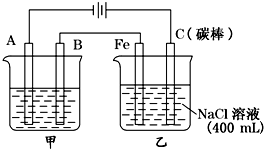 如图为相互串联的甲乙两电解池
如图为相互串联的甲乙两电解池