题目内容
4.X、Y、Z、M、N为短周期的第五种主族元素.其中X、Z同主族,Y、Z同周期,M与X、Y既不同主族,也不同周期.X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6.N是短周期主族元素中原子半径最大的非金属元素.(1)X元素位于元素周期表的位置是第二周期,第VIA族.
(2)请写出下列反应的离子方程式:N单质与氢氧化钠溶液反应:Si+2OH-+H2O=SiO32-+2H2↑.
(3)Y与Z相比,非金属性较强的元素的原子结构示意图为
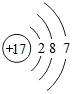 ,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-=2Cl-+S↓.
,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-=2Cl-+S↓.(4)请将X、Z、M、N元素原子半径从大到小排序:Si>S>O>H(硅>硫>氧>氢)(用元素符号表示)
分析 X、Y、Z、M、N为短周期的五种主族元素,X原子最外层电子数是核外电子层数的三倍,原子只能有2个电子层,最外层电子数为6,则X为O元素;X、Z同主族,则Z为S元素;Y的最高化合价与其最低化合价的代数和等于6,处于ⅦA族,且Y、Z同周期,则Y为Cl;N是短周期主族元素中原子半径最大的非金属元素,则N为Si;M与X、Y既不同族,也不同周期,则M为H元素,据此进行解答.
解答 解:X、Y、Z、M、N为短周期的五种主族元素,X原子最外层电子数是核外电子层数的三倍,原子只能有2个电子层,最外层电子数为6,则X为O元素;X、Z同主族,则Z为S元素;Y的最高化合价与其最低化合价的代数和等于6,处于ⅦA族,且Y、Z同周期,则Y为Cl;N是短周期主族元素中原子半径最大的非金属元素,则N为Si;M与X、Y既不同族,也不同周期,则M为H元素,
(1)X为O元素,其原子序数为8,位于周期表中第二周期、VIA族,
故答案为:二;VIA;
(2)N为Si元素,Si单质与氢氧化钠溶液反应的离子方程式为:Si+2OH-+H2O=SiO32-+2H2↑,
故答案为:Si+2OH-+H2O=SiO32-+2H2↑;
(3)S与Cl相比,非金属性较强的元素是Cl,氯原子的原子序数为17,最外层含有7个电子,其原子结构示意图为: ;
;
通过反应Cl2+S2-=2Cl-+S↓可以证明氯气的氧化性大于S,则说明非金属性Cl>S,
故答案为: ;Cl2+S2-=2Cl-+S↓;
;Cl2+S2-=2Cl-+S↓;
(4)电子层越多,原子半径越大;电子层相同时,原子序数越大,原子半径越小,则原子半径大小为:N>Z>X>M,即Si>S>O>H(硅>硫>氧>氢),
故答案为:Si>S>O>H(硅>硫>氧>氢).
点评 本题考查位置、结构及性质的应用,为高频考点,题目难度中等,把握元素在周期表的位置、周期表的结构及元素化合物知识为解答的关键,侧重知识综合应用能力的考查.

| A. | 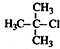 2-甲基氯丙烷 2-甲基氯丙烷 | B. | 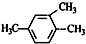 1,2,4-三甲苯 1,2,4-三甲苯 | C. | 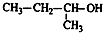 2-甲基-1-丙醇 2-甲基-1-丙醇 | D. | 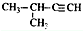 2-甲基-3-丁炔 2-甲基-3-丁炔 |
| A. | NaCl | B. | CaCl2 | C. | AlCl3 | D. | MgSO4 |
| A. | 聚乳酸是一种纯净物 | |
| B. | 聚乳酸的聚合方式与聚苯乙烯相似 | |
| C. | 聚乳酸的单体为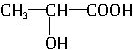 | |
| D. | 聚乳酸的降解过程不需要其他物质参与反应 |
| A. | 1gH2 | B. | 11gCO2 | C. | 8gO2 | D. | 4.5gH2O(g) |
| A. | 1.5 mol | B. | 3 mol | C. | 5 mol | D. | 6 mol |