题目内容
7.(1)室温下,pH=13的NaOH溶液中,水电离出的c(H+)=a;pH=10的CH3COONa溶液中,水电离出的c(H+)=b,则a:b=1:109.(2)中和相同体积、相同pH值的Ba(OH)2、NaOH和NH3•H2O三种稀溶液,所用相同物质的量浓度的盐酸的体积分别为V1、V2、V3,则三者关系为:V1=V2<V3.
(3)已知(NH4)2A溶液是中性,又知将H2A溶液加入到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH> 7 (选填“>”、“<”或“=”);
(4)氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,同时还产生的现象有:有红褐色沉淀生成,有气泡生成;用离子方程式表示产生上述现象的原因Fe3++3H2O?Fe(OH)3+3H+、CaCO3+2H+=Ca2++CO2↑+H2O.在饱和氯化铁溶液中加入一种单质,也会产生类似上述现象,这种单质是C (填字母)
A.碳B.硫 C.镁 D.铜
(5)在含有Cl-、Br-、I-的溶液中,已知其浓度均为0.1mo1/L,已知AgCl、AgBr、AgI的溶度积分别为1.6×10-10、4.1×10-15、1.5×10-16,若向混合溶液中逐滴加入AgNO3溶液,试回答:
①当AgBr沉淀开始析出时,溶液中Ag+浓度是4.1×10-14mo1/L
②当AgCl沉淀开始析出时,溶液中的I-的浓度为:9.375×10-8mol/l.
分析 (1)碱抑制水电离,含有弱酸根离子的盐促进水电离,所以氢氧化钠溶液中水电离出的c(OH-) 等于C(H+),醋酸钠溶液中水电离出的c(OH-) 等于水离子积常数与C(H+)的比值;
(2)等体积、等pH的Ba(OH)2、NaOH中,c(OH-)相同,但NH3•H2O为弱碱,等pH时,其浓度大于NaOH,然后结合酸碱中和时c(OH-)越大,消耗酸越多;
(3)(NH4)2A溶液是中性,说明NH4+和A2-离子水解程度相等,则一水合氨和H2A电离平衡常数相等,H2A溶液加入到Na2CO3溶液中有气体放出,说明H2A酸性大于H2CO3,则CO32-水解程度大于NH4+;
(4)化铁水解呈酸性,可使碳酸钙溶解生成二氧化碳气体,溶液中水解平衡正向进行生成;饱和氯化铁溶液中存在Fe3++3H2O?Fe(OH)3+3H+,若生成气体和红褐色沉淀,平衡正向进行,且加入的物质和酸反应放出氢气;
(5)①根据溶度积常数计算各沉淀生成时所需银离子的浓度;
②计算出溴离子、碘离子浓度分别为1.0×10-5mol/L时银离子浓度,然后根据氯化银开始沉淀时银离子浓度进行比较,即可判断当AgC1沉淀开始析出时,溶液中的Br-、I-是否完全沉淀.
解答 解:(1)氢氧化钠抑制水电离,醋酸钠促进水电离,所以氢氧化钠溶液中水电离出的c(OH-)等于c(H+),醋酸钠溶液中水电离出的c(OH-)等于水离子积常数与C(H+)的比值,则氢氧化钠溶液中水电离出的c(OH-)=10-13 mol/L,醋酸钠溶液中水电离出的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-10}}$mol/L=10-4 mol/L,所以a:b=10-13:10-4=1:109;
故答案为:1:109;
(2)等体积、等pH的Ba(OH)2、NaOH中,c(OH-)相同,滴加等浓度的盐酸将它们恰好中和,用去酸的体积V1=V2,
但NH3•H2O为弱碱,等pH时,其浓度大于NaOH,滴加等浓度的盐酸将它们恰好中和,弱碱继续电离产生氢氧根离子,则消耗酸多,即V3>V2,
所以消耗酸的体积关系为:V1=V2<V3,
故答案为:V1=V2<V3;
(3)(NH4)2A溶液是中性,说明NH4+和A2-离子水解程度相等,则一水合氨和H2A电离平衡常数相等,H2A溶液加入到Na2CO3溶液中有气体放出,说明H2A酸性大于H2CO3,则CO32-水解程度大于NH4+,CO32-水解显碱性,所以该溶液呈碱性,pH>7,
故答案为:>;
(4)氯化铁水解呈酸性,Fe3++3H2O?Fe(OH)3+3H+,可使碳酸钙溶解,反应的方程式为CaCO3+2H+=Ca2++H2O+CO2↑,反应消耗H+,使c(H+)减小,引起水解平衡向右移动,导致Fe(OH)3增多,溶液颜色变深或溶液为红褐色或久置有红褐色沉淀;在饱和氯化铁溶液中加入一种单质,也会发生类似上述现象的反应,平衡正向进行,且加入的物质和酸反应放出氢气,选项中AB是非金属单质不能和酸反应,铜是金属不能和稀酸反应,镁和溶液中稀酸反应生成氢气,促进平衡正向进行,生成氢氧化铁红褐色沉淀;
故答案为:有红褐色沉淀生成,有气泡生成;Fe3++3H2O?Fe(OH)3+3H+、CaCO3+2H+=Ca2++CO2↑+H2O; C;
(5)①当生成AgBr沉淀时,所需银离子的浓度为:c(Ag+ )=$\frac{4.1×1{0}^{-15}}{0.1}$mol/L=4.1×10-14mol/l,
故答案为:4.1×10-14mo1/L;
②当生成AgCl沉淀时,所需银离子的浓度为:c(Ag+ )=$\frac{Ksp}{c(C{l}^{-})}$=$\frac{1.6×1{0}^{-10}}{0.1}$mol/L=1.6×10-9mol/l,此时I-离子浓度为:c(I-)=$\frac{Ksp}{c(A{g}^{+})}$=$\frac{1.5×1{0}^{-16}}{1.6×1{0}^{-9}}$mol/L=9.375×10-8mol/l;
故答案为:9.375×10-8mol/l.
点评 本题考查了水的电离、盐的水解原理及其应用、难溶电解质的溶解平衡及沉淀转化的本质,题目难度中等,试题涉及的知识点较多、题量稍大,注意掌握pH的有关计算的方法,明确盐的水解原理,掌握沉淀转化本质及其应用方法.

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案| A. | HCl | B. | NaOH | C. | Na2SO4 | D. | NaCl |
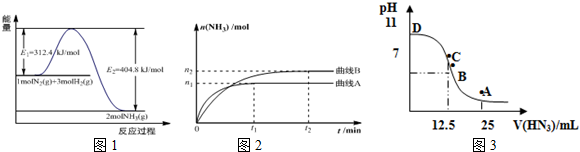
(1)图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图2是合成氨反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图.
①下列说法正确的是BDE.
A.使用催化剂会使E1的数值增大
B.△H=-92.4kJ•mol-1
C.为了提高转化率,工业生产中反应的温度越低越好
D.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为$\frac{{n}_{1}}{4{t}_{1}}$mol•L-1•min-1
E.该反应的平衡常数KA<KB
F.图2是不同压强下反应体系中氨的物质的量与反应时间关系图,且PA<PB
②下列能说明该反应达到平衡状态的是D
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.v正(N2)=v逆(H2)
C.混合气体的密度保持不变
D.容器内压强保持不变
(2)合成氨技术的创立开辟了人工固氮的重要途径,合成氨反应的平衡常数K值和温度的关系如下:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
(3)常温下向25mL0.1mol/LNH3•H2O 溶液中,逐滴加入 0.2mol/L的HN3溶液,溶液的pH变化曲线如图3所示.
A、B、C、D 四个点中,水的电离程度最大的是C;A点时溶液中各离子浓度由小到大的顺序为c(OH-)<c(H+)<c(NH4+)<c(N3-).
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池.试写出该电池的正极反应式N2+8H++6e-═2NH4+.
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为SO2.
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是黑色沉淀中不含有CuO.
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
| 装置 | 现象 | 结论及解释 |
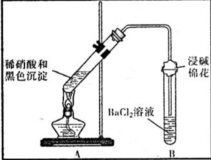 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为40%.
| A. | CO2 | B. | CaO | C. | Na2O2 | D. | Al2O3 |
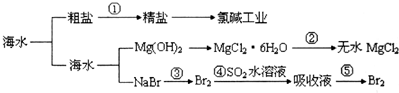
| A. | 第①步中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 工业上金属钠是通过氯碱工业制取的 | |
| C. | ④和⑤步的目的是为了浓缩 | |
| D. | 第③④⑤步中溴元素均被氧化 |
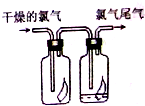 如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到右瓶的现象是:有色布条褪色,发生此现象的原因是Cl2+H2O?HCl+HClO.(用有关的方程式解释)
如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到右瓶的现象是:有色布条褪色,发生此现象的原因是Cl2+H2O?HCl+HClO.(用有关的方程式解释)