题目内容
17.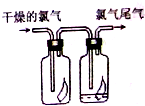 如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到右瓶的现象是:有色布条褪色,发生此现象的原因是Cl2+H2O?HCl+HClO.(用有关的方程式解释)
如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到右瓶的现象是:有色布条褪色,发生此现象的原因是Cl2+H2O?HCl+HClO.(用有关的方程式解释)
分析 气无漂白性,氯气与水反应生成的次氯酸具有漂白性,由此分析解答
解答 解:氯气没有漂白性,所以干燥的氯气不能使有色布条褪色,氯气和水反应生成盐酸和次氯酸,次氯酸有强氧化性而使有色布条褪色,所以可观察到右瓶的现象是有色布条褪色,反应方程式为:Cl2+H2O?HCl+HClO;
故答案为:有色布条褪色;Cl2+H2O?HCl+HClO.
点评 本题考查了氯气化学性质的应用,明确具有漂白性的是次氯酸是解答本题的关键,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.相同状况下,在体积相同的三个烧瓶中,分别盛满NH3、HCl、NO2气体,分别倒扣在水槽中,充分溶解后,将瓶口塞好取出(设烧瓶内气体不扩散),则烧瓶内三种溶液的物质的量浓度之比为( )
| A. | 3:3:2 | B. | 5:5:4 | C. | 2:2:3 | D. | 1:1:1 |
5.当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A. | 泥水 | B. | 盐酸 | C. | Fe(OH)3胶体 | D. | NaCl溶液 |
12.下列实验现象与氧化还原反应有关的是( )
| A. | 氨水中滴加石蕊试液显蓝色 | |
| B. | NO2通入水中,气体由红棕色逐渐转变为无色 | |
| C. | 萃取时向碘水中滴加适量的稀盐酸,有透明的凝胶形成 | |
| D. | 向硅酸钠溶液中滴加适量的稀盐酸,有透明的凝胶形成 |
2.下列实验操作或实验事故处理正确的是( )
| A. | 不慎将浓碱溶液沾到皮肤上,立即用大量硫酸冲洗,然后再用水冲洗 | |
| B. | 不慎将酸溅到眼中,立即用大量水冲洗,边洗边眨眼睛 | |
| C. | 实验时手指上不小心沾上浓硫酸,立即用NaOH溶液清洗 | |
| D. | 酒精不慎洒在实验桌上烧起来时,立即用水浇灭 |
6.某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还含有一定量的SiO2)可用于制备FeCO3,其流程如图:
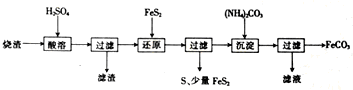
已知:还原时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ为FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
(1)反应Ⅰ中还原剂是FeS2.
(2)滤渣的成分是二氧化硅(填名称).
(3)所得FeCO3需充分洗涤,检验FeCO3是否洗净的方法是取少许最后一次洗涤液于试管中,滴加稀盐酸,待无明显现象后,再滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净.反之,则说明没洗涤干净.
(4)①配平反应Ⅱ的离子方程式:2Fe3++1FeS2=2S↓+3Fe2+.
②还原前后溶液中部分离子的浓度见表(溶液体积变化忽略不计):
则反应Ⅰ、Ⅱ中生成Fe2+的物质的量之比为5:3.

已知:还原时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ为FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
(1)反应Ⅰ中还原剂是FeS2.
(2)滤渣的成分是二氧化硅(填名称).
(3)所得FeCO3需充分洗涤,检验FeCO3是否洗净的方法是取少许最后一次洗涤液于试管中,滴加稀盐酸,待无明显现象后,再滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净.反之,则说明没洗涤干净.
(4)①配平反应Ⅱ的离子方程式:2Fe3++1FeS2=2S↓+3Fe2+.
②还原前后溶液中部分离子的浓度见表(溶液体积变化忽略不计):
| 离子 | 离子浓度(mol?L-1) | |
| 还原前 | 还原后 | |
| Fe2+ | 0.10 | 2.50 |
| SO42- | 3.50 | 3.70 |
7.增塑剂DCHP可由邻苯二甲酸酐与环己醇反应制得,下列叙述正确的是( )
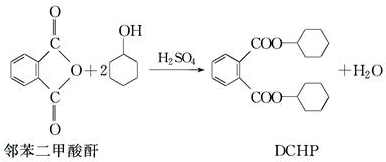

| A. | 邻苯二甲酸酐属于酸性氧化物 | |
| B. | 环己醇分子中所有的原子可能共平面 | |
| C. | DCHP能发生加成、取代、消去反应 | |
| D. | 1molDCHP最多可与含2molNaOH的烧碱溶液反应 |
 .
.