题目内容
设NA为阿伏加德罗常数的值.下列叙述不正确的是( )
| A、一定温度下,15g甲醛和乙酸的混合物中O原子数为0.5NA |
| B、标准状况下,NO和O2各11.2L混合,所得混合气体的分子总数为0.75NA |
| C、14g分子通式为CnH2n的链烃中含有的C=C的数目为NA/n |
| D、在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.甲醛和乙酸具有相同的最简式CH2O,据此计算解答;
B.NO和O2各反应生成二氧化氮,二氧化氮聚合为四氧化二氮;
C.依据链烃通式CnH2n判断该链烃为烯烃,含有一个碳碳双键,据此计算解答;
D.依据方程式中碘元素化合价的变化可知,生成3mol碘单质转移了5mol电子.
B.NO和O2各反应生成二氧化氮,二氧化氮聚合为四氧化二氮;
C.依据链烃通式CnH2n判断该链烃为烯烃,含有一个碳碳双键,据此计算解答;
D.依据方程式中碘元素化合价的变化可知,生成3mol碘单质转移了5mol电子.
解答:
解:A.甲醛和乙酸具有相同的最简式CH2O,15g甲醛和乙酸的混合物中O原子数为
×1×NA=0.5NA,故A正确;
B.一氧化氮和氧气反应生成二氧化氮,标准状况下,11.2LNO为0.5mol,11.2LO2物质的量为0.5mol,发生反应2NO+O2=2NO2,生成0.5molNO2,剩余0.25molO2,二氧化氮聚合为四氧化二氮,混合后气体的分子总数小于0.75NA,故B错误;
C.依据链烃通式CnH2n可知该链烃为烯烃,其中必定含有一碳碳双键,14g的该烯烃,物质的量=14g/14n=1/n mol,因为1mol 分子中含有的分子数目为NA,所以,1/n mol分子中含有分子数为NA/n个,又每个烯烃分子中含有一个双键,所以,14g的该烯烃,含有的碳碳键数目是NA/n,故C正确;
D.依据方程式可知,生成3mol碘单质转移了5mol电子,故D错误;
故选:BD.
| 15g |
| 30g/mol |
B.一氧化氮和氧气反应生成二氧化氮,标准状况下,11.2LNO为0.5mol,11.2LO2物质的量为0.5mol,发生反应2NO+O2=2NO2,生成0.5molNO2,剩余0.25molO2,二氧化氮聚合为四氧化二氮,混合后气体的分子总数小于0.75NA,故B错误;
C.依据链烃通式CnH2n可知该链烃为烯烃,其中必定含有一碳碳双键,14g的该烯烃,物质的量=14g/14n=1/n mol,因为1mol 分子中含有的分子数目为NA,所以,1/n mol分子中含有分子数为NA/n个,又每个烯烃分子中含有一个双键,所以,14g的该烯烃,含有的碳碳键数目是NA/n,故C正确;
D.依据方程式可知,生成3mol碘单质转移了5mol电子,故D错误;
故选:BD.
点评:本题考查了阿伏伽德罗常数的应用于计算,题目难度中等,B为易错选项,解题时容易忽略二氧化氮与四氧化二氮的转化.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列指定溶液中一定能大量共存的离子组是( )
A、pH=1的溶液中:N
| ||||||
B、含有大量Al
| ||||||
C、碱性溶液中:K+、Al3+、Cl-、S
| ||||||
D、Na2S溶液中:S
|
下面有关氧化还原反应的叙述中,正确的是( )
| A、在反应中不一定所有元素的化合价都发生变化 |
| B、非金属单质在反应中只作氧化剂 |
| C、肯定有一种元素被氧化,另一种元素被还原 |
| D、金属原子失电子越多,其还原性越强 |
下列物质与其用途完全符合的是( )
①Na2CO3制玻璃 ②SiO2太阳能电池 ③AgI人工降雨 ④NaCl制纯碱 ⑤Al2O3焊接钢轨 ⑥NaClO消毒剂 ⑦Fe2O3红色油漆或涂料⑧HF(aq)雕刻玻璃.
①Na2CO3制玻璃 ②SiO2太阳能电池 ③AgI人工降雨 ④NaCl制纯碱 ⑤Al2O3焊接钢轨 ⑥NaClO消毒剂 ⑦Fe2O3红色油漆或涂料⑧HF(aq)雕刻玻璃.
| A、①③④⑥⑦⑧ |
| B、①②③⑤⑥⑦⑧ |
| C、①③⑤⑦⑧ |
| D、①②③④⑤⑥⑦ |
增大反应物的浓度、增大气体的压强、升高体系的温度、使用催化剂都可以加快化学反应速率,其中能增大活化分子百分数的是( )
①增大反应物的浓度②增大气体的压强③升高体系的温度④使用催化剂.
①增大反应物的浓度②增大气体的压强③升高体系的温度④使用催化剂.
| A、①② | B、②③ | C、①④ | D、③④ |
在恒温恒容条件下,一定能使反应A(g)+B(s)?C(g)+D(g)的反应速率增大的措施是( )
| A、减小A或B的用量 |
| B、减小C的量 |
| C、增大B的量 |
| D、增大D的量 |
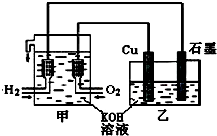 利用如图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )
利用如图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )| A、乙中Cu电极的电极反应式是:2Cu+2OH--2e-=Cu2O+H2O |
| B、甲中通入氧气的电极为负极 |
| C、乙中阴离子向石墨电极移动 |
| D、电路上通过0.5mol电子,可制得0.5mol Cu2O |
下列说法错误的是( )
| A、含有共价键的化合物不一定是共价化合物 |
| B、在共价化合物中一定含有共价键 |
| C、含有离子键的化合物一定是离子化合物 |
| D、离子键就是阴阳离子结合成化合物的静电引力 |