题目内容
增大反应物的浓度、增大气体的压强、升高体系的温度、使用催化剂都可以加快化学反应速率,其中能增大活化分子百分数的是( )
①增大反应物的浓度②增大气体的压强③升高体系的温度④使用催化剂.
①增大反应物的浓度②增大气体的压强③升高体系的温度④使用催化剂.
| A、①② | B、②③ | C、①④ | D、③④ |
考点:化学反应速率的影响因素
专题:化学平衡专题
分析:一般来说,升高温度、加入催化剂等,都可增加反应物分子中活化分子百分数,而增大浓度、压强等只能增大单位体积的活化分子数目,但百分数不变,以此解答.
解答:
解:①增大反应物的浓度,单位体积活化分子数目增大,但百分数不变,故错误;
②增大气体的压强单位体积活化分子数目增大,但百分数不变,故错误;
③升高体系的温度,可增大活化分子百分数,故正确;
④使用催化剂,可以降低活化能,使更多的普通分子转化为活化分子,故活化分子的百分数增加,故正确.
故选D.
②增大气体的压强单位体积活化分子数目增大,但百分数不变,故错误;
③升高体系的温度,可增大活化分子百分数,故正确;
④使用催化剂,可以降低活化能,使更多的普通分子转化为活化分子,故活化分子的百分数增加,故正确.
故选D.
点评:本题考查影响活化分子的因素,题目难度不大,注意外界条件对活化分子的影响不同,把握相关基础知识的积累.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
下列各组物质按酸碱盐分类顺序排列,正确的是( )
| A、硫酸、纯碱、硫酸钙 |
| B、氢硫酸、烧碱、胆矾 |
| C、碳酸、乙醇、醋酸钠 |
| D、磷酸、熟石灰、苛性钠 |
 将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示.此电池工作时,下列叙述正确的是( )
将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示.此电池工作时,下列叙述正确的是( )①镁为正极
②电子由铝片通过导线流向镁片
③该电池的内电路中,阳离子向负极迁移
④镁片上发生的反应为:Mg-2e-═Mg2+
⑤该装置能够将电能转化为化学能
⑥负极反应为 Al-3e-+4OH-═AlO2-+2H2O
⑦正极发生还原反应,负极发生氧化反应
⑧Al是电池负极,开始工作时溶液中会立即有白色沉淀析出.
| A、①②⑦⑧ | B、③④⑤⑥ |
| C、①②⑥⑦ | D、②③⑤⑧ |
如将物质按照单质、氧化物、酸、碱、盐分类,下列各组物质中,类别相同的是( )
| A、氧气、氧化镁、四氯化碳、水 |
| B、硫酸铜、氯化钠、碳酸钙、硫化钾 |
| C、硫酸、碳酸钠、氯化镁、氧化钠 |
| D、硝酸银、氢氧化钠、醋酸钠、氯化钾 |
下列有机化学反应中,属于消去反应的是( )
| A、苯与浓硫酸、浓硝酸混合,温度保持在50℃~60℃ |
| B、溴丙烷与氢氧化钠溶液混合,静置 |
| C、乙醇与浓硫酸共热,温度保持在170℃ |
| D、1-氯丁烷与氢氧化钾水溶液共热 |
设NA为阿伏加德罗常数的值.下列叙述不正确的是( )
| A、一定温度下,15g甲醛和乙酸的混合物中O原子数为0.5NA |
| B、标准状况下,NO和O2各11.2L混合,所得混合气体的分子总数为0.75NA |
| C、14g分子通式为CnH2n的链烃中含有的C=C的数目为NA/n |
| D、在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA |
下列比较中正确的是( )
| A、溶液碱性:KOH>LiOH |
| B、溶液酸性:HNO3<H2CO3 |
| C、原子半径:S<F |
| D、硫与氢气反应比氟与氢气反应更容易 |
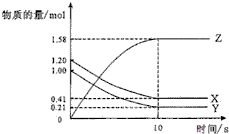 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述错误的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述错误的是( )| A、达到平衡所需要的时间是10s |
| B、平衡时Y的转化率79.0% |
| C、该反应的化学方程式为X(g)+Y(g)?2Z(g) |
| D、前10s,用Z表示的反应速率为0.79mol/(L?s) |