题目内容
 利用如图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )
利用如图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )| A、乙中Cu电极的电极反应式是:2Cu+2OH--2e-=Cu2O+H2O |
| B、甲中通入氧气的电极为负极 |
| C、乙中阴离子向石墨电极移动 |
| D、电路上通过0.5mol电子,可制得0.5mol Cu2O |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:甲装置是燃料电池,负极上电极反应式为H2+2OH-+2e-=2H2O,正极上电极反应式为O2+2H2O+4e-=4OH-,乙电池中阳极上电极反应式为2Cu+2OH--2e-=Cu2O+H2O,阴极上电极反应式为2H++2e-=H2↑,据此分析解答.
解答:
解:甲中通入氧气的电极是正极、通入氢气的电极是分解,所以乙中Cu是阳极、石墨是阴极,
A.乙中Cu电极上Cu失电子发生氧化反应,所以Cu的电极反应式是:2Cu+2OH--2e-=Cu2O+H2O,故A正确;
B.甲中通入氧化剂的电极是正极,所以通入氧气的电极是正极,故B错误;
C.乙中阴离子向阳极移动,则阴离子向Cu电极移动,故C错误;
D.电路上通过0.5mol电子,可制得0.25mol Cu2O,故D错误;
故选A.
A.乙中Cu电极上Cu失电子发生氧化反应,所以Cu的电极反应式是:2Cu+2OH--2e-=Cu2O+H2O,故A正确;
B.甲中通入氧化剂的电极是正极,所以通入氧气的电极是正极,故B错误;
C.乙中阴离子向阳极移动,则阴离子向Cu电极移动,故C错误;
D.电路上通过0.5mol电子,可制得0.25mol Cu2O,故D错误;
故选A.
点评:本题考查了原电池原理和电解原理,明确各个电极上发生的反应是解本题关键,难点是电极反应式的书写,要结合电解质溶液书写,题目难度中等.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
下列物质不是胶体的是( )
| A、淀粉溶液 | B、烟雾 |
| C、豆浆 | D、蔗糖溶液 |
如将物质按照单质、氧化物、酸、碱、盐分类,下列各组物质中,类别相同的是( )
| A、氧气、氧化镁、四氯化碳、水 |
| B、硫酸铜、氯化钠、碳酸钙、硫化钾 |
| C、硫酸、碳酸钠、氯化镁、氧化钠 |
| D、硝酸银、氢氧化钠、醋酸钠、氯化钾 |
设NA为阿伏加德罗常数的值.下列叙述不正确的是( )
| A、一定温度下,15g甲醛和乙酸的混合物中O原子数为0.5NA |
| B、标准状况下,NO和O2各11.2L混合,所得混合气体的分子总数为0.75NA |
| C、14g分子通式为CnH2n的链烃中含有的C=C的数目为NA/n |
| D、在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA |
下列比较中正确的是( )
| A、溶液碱性:KOH>LiOH |
| B、溶液酸性:HNO3<H2CO3 |
| C、原子半径:S<F |
| D、硫与氢气反应比氟与氢气反应更容易 |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A、在0.1 mol/L NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B、在0.1 mol/L Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) |
| C、向0.2mol/LNaHCO3溶液中加入等体积0.1 mol/LNaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、0.2 mol/L的NaHCO3溶液中c(H+)+c(H2CO3)=c(CO32-)+c(OH-) |
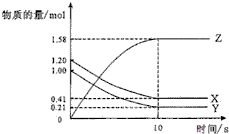 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述错误的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述错误的是( )| A、达到平衡所需要的时间是10s |
| B、平衡时Y的转化率79.0% |
| C、该反应的化学方程式为X(g)+Y(g)?2Z(g) |
| D、前10s,用Z表示的反应速率为0.79mol/(L?s) |
 利用太阳能分解水产生H2,在催化剂作用下H2与CO2反应合成CH3OH,并开发出直接以甲醇为燃料的燃料电池.已知:
利用太阳能分解水产生H2,在催化剂作用下H2与CO2反应合成CH3OH,并开发出直接以甲醇为燃料的燃料电池.已知: