题目内容
15.已知砷(As)元素原子的最外层电子排布是 4s24p3.在元素周期表里,砷元素位于第四周期第ⅤA族,p区元素,最高价氧化物的化学式是As2O5,写出砷原子最外层电子排布图 AsH3分子的VSEPR模型名称四面体结构,立体构型名称为三角锥,含有的共价键为极性键(极性键,非极性键),属于极性分子(极性分子,非极性分子),砷原子采取sp3杂化.
AsH3分子的VSEPR模型名称四面体结构,立体构型名称为三角锥,含有的共价键为极性键(极性键,非极性键),属于极性分子(极性分子,非极性分子),砷原子采取sp3杂化.
分析 主族元素周期数=电子层数、主族族序数=最外层电子数;最高正化合价=最外层电子数,据此判断最高正化合价,书写氧化物化学式,核外电子排布为:1S22S22P63S23P64S23d104S24P3,砷原子最外层电子排布图为 ,因As是sp3杂化,所以AsH3分子的VSEPR模型名称是四面体结构;立体构型名称为三角锥,不同原子间形成的共价键是极性键,正负电荷中心不重合属于极性分子,由此分析解答.
,因As是sp3杂化,所以AsH3分子的VSEPR模型名称是四面体结构;立体构型名称为三角锥,不同原子间形成的共价键是极性键,正负电荷中心不重合属于极性分子,由此分析解答.
解答 解:砷(As)元素原子的最外层电子排布是4s24p3,原子电子数是为4、最外层电子数为5,故处于第四周期第ⅤA族,p区元素,最高正化合价为+5,最高价氧化物的化学式是As2O5,砷原子最外层电子排布图为 ,SEPR模型名称是四面体结构;立体构型名称为三角锥,有的共价键为极性键,属于极性分子,砷原子采取sp3杂化,故答案为:四;ⅤA;p;As2O5;
,SEPR模型名称是四面体结构;立体构型名称为三角锥,有的共价键为极性键,属于极性分子,砷原子采取sp3杂化,故答案为:四;ⅤA;p;As2O5; ;四面体结构;三角锥;极性键;极性分子;sp3.
;四面体结构;三角锥;极性键;极性分子;sp3.
点评 本题考查核外电子排布规律等,难度不大,理解核外电子排布规律,难度不大.

练习册系列答案
相关题目
5.下列说法正确的是( )
| A. | 胆矾(CuSO4•5H2O)是混合物 | |
| B. | 加热胆矾失去结晶水的过程是风化 | |
| C. | 氯化钙易吸水而发生潮解,所以可作干燥剂 | |
| D. | 从饱和溶液中析出的晶体都含有结晶水 |
6.下列说法正确的是( )
| A. | 1 mol H2SO4与 1 mol Ba(OH)2完全反应放出的热量叫做中和热 | |
| B. | 用弱酸的稀溶液做中和热测定实验,测得中和反应反应热偏大 | |
| C. | 一定量H2燃烧生成气态水时比生成液态水时放出的热量多 | |
| D. | 在101 kPa时,1 molH2在Cl2中燃烧时放出的热量也是H2的燃烧热 |
10.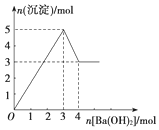 如图表示向某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )
如图表示向某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )
 如图表示向某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )
如图表示向某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )| A. | MgSO4 | B. | Al2(SO4)3 | C. | FeSO4 | D. | NaAlO2 |
7.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 能使酚酞试液变红的溶液中:H+、SO42-、Na+、NO3- | |
| B. | 加入Al能放出氢气的溶液中:NH4+、SO42-、Mg2+、HCO3- | |
| C. | 含有大量Cl2的溶液中:Ba2+、K+、NO3-、I- | |
| D. | 强酸性的溶液中:Cu2+、Br-、Ca2+、Cl- |
4.下列反应中,属于氧化还原反应的是( )
| A. | CaO+H2O═Ca(OH)2 | B. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$2H2O+CO2 | ||
| C. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | Na2SiO3+2HCl═2NaCl+H2SiO3(胶体) |
5.下列叙述正确的是( )
| A. | 0.1mol•L-1氨水中,c(OH-)=c(NH4+) | |
| B. | 在0.1mol•L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) | |
| C. | 10 mL 0.02mol•L-1HCl溶液与10 mL 0.02mol•L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=10 | |
| D. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A) |