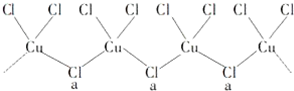
题目内容
14.将甲烷设计成燃料电池,其利用率更高,如图所示(A,B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL,则下列说法错误的是( )
| A. | 通入CH4的一端为原电池的负极,溶液中OH-向负极区移动 | |
| B. | 当0<V≤22.4L时,电池总反应式为CH4+2O2+2KOH═K2CO3+3H2O | |
| C. | 当22.4L<V≤44.8L时,负极电极反应为CH4-8e-+9CO32-+3H2O═10HCO3- | |
| D. | 当V=33.6L时,溶液中阴离子浓度大小关系为c(CO32- )>c(HCO3-)>c(OH-) |
分析 燃料电池中,通入燃料的一端为原电池的负极,通入空气的一端为原电池的正极,阴离子向负极移动,阳离子移向正极,n(KOH)=2mol/L×1L=2mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;根据甲烷的量计算生成的二氧化碳的量,结合反应方程式判断反应产物及发生的反应.
解答 解:A.燃料电池中,通入CH4的一端为原电池的负极,溶液中OH-向负极区移动,故A正确;
B.当0<V≤22.4L时,0<n(CH4)≤1mol,则0<n(CO2)≤1mol,只发生反应①②,且KOH过量,则电池总反应式为CH4+2O2+2KOH=K2CO3+3H2O,故B正确;
C.当22.4 L<V≤44.8L,1mol<n(CH4)≤2mol,则1mol<n(CO2)≤2mol,发生反应①②③,得到K2CO3和KHCO3溶液,则负极反应式为CH4-8e-+9CO32-+3H2O=10HCO3-,故C正确;
D.当V=33.6L时,n(CH4)=1.5mol,n(CO2)=1.5mol,则电池总反应式为3CH4+6O2+4KOH=K2CO3+2KHCO3+7H2O,则得到0.5molK2CO3和1molKHCO3的溶液,则c(HCO3-)>c(CO32-)>c(OH-),故D错误;
故选D.
点评 本题考查了燃料电池的工作原理,注意二氧化碳与电解质氢氧化钾反应量的判断,计算要求的综合性较强,难度较大.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
6.向一定量的Fe、FeO和Fe2O3的混合物中,加入120mL 4mol•L-1的稀硝酸,恰好使混合物完全溶解,放出1.344L(标准状况)气体,往所得溶液中加入KMnO4的酸性溶液,无明显现象,若用足量的H2在加热条件下还原相同质量的混合物,最终得到铁的物质的量为( )
| A. | 0.21mol | B. | 0.14mol | C. | 0.16mol | D. | 0.24mol |
2.下列化学式表示的物质一定是纯净物的是( )
| A. | CH2Br2 | B. | C5H8 | C. | C4H10 | D. | C7H8O |
9.下列说法正确的是( )
| A. | 碳-14 核素:148C | |
| B. | HClO 的结构式为 H-O-Cl | |
| C. | 化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种 | |
| D. | H2S、PH3、HCl、HF 的热稳定性依次增强 |
3.下列有机反应中,不属于取代反应的是( )
| A. | 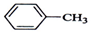 +Cl2$\stackrel{光照}{→}$ +Cl2$\stackrel{光照}{→}$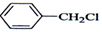 +HCl +HCl | |
| B. | 2CH3CH2+O2$→_{△}^{Cu}$2CH3CHO+2H20 | |
| C. | ClCH2=CH2+NaOH $→_{△}^{H_{2}O}$ HOCH2CH=CH2+NaCl | |
| D. | 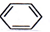 +HONO2 $→_{△}^{浓硫酸}$ +HONO2 $→_{△}^{浓硫酸}$ 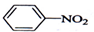 +H2O +H2O |
1.下列说法正确的是( )
| A. | 摩尔是物质的质量单位 | B. | H2的摩尔质量是2g | ||
| C. | 1molH2O的质量是18g | D. | 1molO2的体积是22.4L |