题目内容
丙烯酸(CH3COOCH2-CH=CH-COOH)的性质可能有( )①加成反应 ②水解反应 ③酯化反应 ④中和反应 ⑤氧化反应 ⑥取代反应.
| A、只有①③ |
| B、只有①③④ |
| C、只有①③④⑤ |
| D、①②③④⑤⑥ |
考点:有机物的结构和性质
专题:有机物的化学性质及推断
分析:由结构简式可知,分子中含-COOC-、C=C、-COOH,结合酯、烯烃、羧酸的性质来解答.
解答:
解:含-COOC-,可发生水解反应、取代反应;
含C=C,可发生加成反应、氧化反应;
含-COOH,可发生酯化反应、中和反应、取代反应,
故选D.
含C=C,可发生加成反应、氧化反应;
含-COOH,可发生酯化反应、中和反应、取代反应,
故选D.
点评:本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重羧酸、烯烃、酯性质及有机反应的考查,题目难度不大.

练习册系列答案
相关题目
我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流.电池总反应为:4Al+3O2+6H2O═4Al(OH)3,下列说法不正确的是( )
| A、正极反应式为:O2+2H2O+4e-═40H - |
| B、电池工作时,电流由铝电极沿导线流向铂电极 |
| C、以网状的铂为正极,可增大与氧气的接触面积 |
| D、该电池通常只需更换铝板就可继续使用 |
某同学对“CO2是共价化合物和NH4Cl是离子化合物”有下列感悟,其中不正确的是( )
| A、离子化合物中可能含共价键 |
| B、共价化合物中一定不含离子键 |
| C、所有物质中都含有化学键 |
| D、离子化合物中不一定含金属元素 |
X、Y为同周期元素,如果X的原子半径大于Y,则下列判断不正确的是( )
| A、若X、Y均为金属元素,则X的金属性强于Y |
| B、若X、Y均为非金属元素,则Y的气态氢化物比X的稳定 |
| C、若X、Y均为金属元素,则X的阳离子氧化性比Y形成的阳离子强 |
| D、若X、Y均为非金属元素,则最高价含氧酸的酸性Y强于X |
下列说法不正确的是( )
| A、吸热反应不一定需要加热就能发生 |
| B、放热反应在常温下一定很容易发生 |
| C、放热反应有可能也需要加热才能发生 |
| D、反应是放热还是吸热要由反应物和生成物所具有的总能量来决定 |
下列离子在指定条件下一定能大量共存的是( )
| A、滴入酚酞溶液显红色的溶液中:K+、Na+、Cu2+、SO42- |
| B、与铝反应产生氢气的溶液中:Na+、AlO2-、NO3-、HCO3- |
| C、水电离产生的c(H+)=10-13 mol?L-1的溶液中:Na+、Cl-、NO3-、SO42- |
| D、0.1mol?L-1 HNO3溶液中:Mg2+、NH4+、Fe2+、Cl- |
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、常温常压下,9gH2O含有分子数为0.5NA |
| B、标准状况下,以任意比例混合的甲烷和丙烷(C3H8)的气体混合物11.2L,则所含有的分子数为NA |
| C、常温常压下,活泼金属从盐酸中置换出1molH2时发生转移的电子数为2NA |
| D、物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为NA |
下列说法正确的是( )
| A、汽油、柴油和植物油都是碳氢化合物 |
| B、淀粉和蛋白质均可作为生产葡萄糖的原料 |
| C、石油裂化和油脂皂化都是高分子生成小分子的过程 |
| D、装饰材料中的甲醛和芳香烃会造成居室污染 |
下列叙述正确的是( )
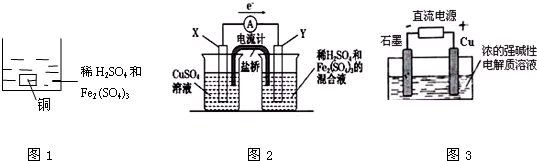

| A、如图1所示将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,若铜片完全溶解时(不考虑盐的水解及溶液体积的变化),溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶液中c(SO42-)为0.5mol/L |
| B、如图2所示的装置中发生Cu+2Fe3+═Cu2++2Fe2+的反应,X极是负极,Y极的材料可以是铜 |
| C、Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图3所示,石墨电极上产生氢气,铜电极发生还原反应 |
| D、如图3所示,当有0.1mol电子转移时,有0.1mol Cu2O生成 |