题目内容
2.现有部分短周期元素的性质或原子结构如下表:| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子数是次外层电子数的2倍 |
| X | L层有三个未成对电子 |
| Y | L层p电子数比s电子数多两个 |
| Z | 元素的最高正价为+7价 |
| A. | Z离子的结构示意图为: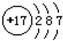 | B. | 分子TY2的键角为180° | ||
| C. | T元素在周期表中的表示为: | D. | XZ3为非极性分子 |
分析 T最外层电子数是次外层电子数的2倍,则T为C,X的L层有三个未成对电子,则X为N,Y的L层p电子数比s电子数多两个,则Y为O,Z元素的最高正价为+7价,且是短周期元素,则Z为Cl,据此答题.
解答 解:T最外层电子数是次外层电子数的2倍,则T为C,X的L层有三个未成对电子,则X为N,Y的L层p电子数比s电子数多两个,则Y为O,Z元素的最高正价为+7价,且是短周期元素,则Z为Cl,
A.Z为Cl,z离子的最外层应有8个电子,故A错误;
B.CO2的分子构型为直线型,所以它的键角为l80°,故B正确;
C.T为C元素, 是O元素在周期表中的表示方法,故C错误;
是O元素在周期表中的表示方法,故C错误;
D.XZ3为NH3,分子中氮原子周围有一对孤电子对,所以氮分子是极性分子,故D错误;
故选B.
点评 本题主要考查了元素周期律以及原子核外电子排布知识,侧重于学生的分析能力的考查,题目难度不大,注意把握原子的结构特点.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
10.下列事实与氢键有关的是( )
| A. | 水加热到很高的温度都难以分解 | |
| B. | 水结成冰体积膨胀,密度变小 | |
| C. | 水分解成氢气和氧气吸收热量 | |
| D. | HF、HCl、HBr、HI的热稳定性依次减弱 |
17.已知反应 A+3B?2C+D 在某段时间内以A的浓度变化表示的化学反应速率为0.5mol/(L•s)则此段时间内以B浓度变化表示的化学反应速率( )
| A. | 0.5 mol/(L•s) | B. | 1.5 mol/(L•s) | C. | 2 mol/(L•s) | D. | 3 mol/(L•s) |
11.对于原电池的电极名称,下列叙述有错误的是( )
| A. | 负极发生氧化反应 | B. | 正极为电子流入的一极 | ||
| C. | 比较不活泼的金属为负极 | D. | 负极为失去电子的一极 |
 ,又知NH4H与水反应有H2生成,下列叙述中不正确的是( )
,又知NH4H与水反应有H2生成,下列叙述中不正确的是( )