题目内容
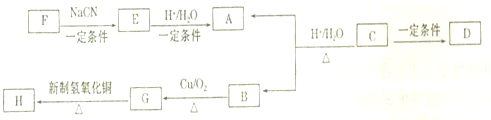
 25℃时,将浓度均为0.1mol?L-1 CH3COOH溶液和HX溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,则下列说法正确的是( )
25℃时,将浓度均为0.1mol?L-1 CH3COOH溶液和HX溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,则下列说法正确的是( )| A、电离平衡常数:CH3COOH>HX>H2CO3 |
| B、将pH=2的CH3COOH溶液和HX溶液稀释10倍后,水电离出的c(H+)较大的为HX溶液 |
| C、往10mL 0.1mol?L-1的Na2CO3溶液中缓慢滴加10mL 0.1mol?L-1的HX,混合后的离子浓度大小关系为c(Na+)>c(HCO3-)>c(X-)>c(OH-)>c(H+) |
| D、当浓度均为0.1mol?L-1的CH3COOH溶液和HX的混合液用标准氢氧化钠溶液滴定至中性时,CH3COOH被完全中和 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.根据图象可知,相同时间内HX产生二氧化碳的速率大于醋酸,说明酸性:HX>CH3COOH>H2CO3,据此判断电离平衡常数;
B.酸性越弱,稀释后溶液中氢离子浓度越大,水电离的氢离子浓度越小;
C.反应后生成碳酸氢钠和NaX溶液,根据越弱越水解判断溶液中水解程度及离子浓度大小;
D.恰好完全反应时生成醋酸钠和NaX溶液,醋酸钠为强碱弱酸盐,此时溶液显示碱性,不是中性,若为中性,则加入的氢氧化钠溶液体积要偏小些.
B.酸性越弱,稀释后溶液中氢离子浓度越大,水电离的氢离子浓度越小;
C.反应后生成碳酸氢钠和NaX溶液,根据越弱越水解判断溶液中水解程度及离子浓度大小;
D.恰好完全反应时生成醋酸钠和NaX溶液,醋酸钠为强碱弱酸盐,此时溶液显示碱性,不是中性,若为中性,则加入的氢氧化钠溶液体积要偏小些.
解答:
解:A.根据图象可知,相同时间内HX产生二氧化碳的速率大于醋酸,说明酸性:HX>CH3COOH>H2CO3,则电离平衡常数大小为:HX>CH3COOH>H2CO3,故A错误;
B.将pH=2的CH3COOH溶液和HX溶液稀释10倍后,酸性越弱,稀释后溶液中氢离子浓度越大,氢离子浓度越大,水的电离程度越小,则稀释后水电离出的c(H+)浓度较大的为HX,故B正确;
C.往10mL 0.1mol?L-1的Na2CO3溶液中缓慢滴加10mL 0.1mol?L-1的HX,反应生成碳酸氢钠和NaX,由于酸性HX>H2CO3,则cHCO3-的水解程度大于X-,溶液中离子浓度大小为:c(HCO3-)<c(X-),故C错误;
D.溶液为中性时,加入的氢氧化钠溶液体积偏小,氢氧化钠的物质的量小于醋酸,此时醋酸有剩余,没有完全反应,故D错误;
故选B.
B.将pH=2的CH3COOH溶液和HX溶液稀释10倍后,酸性越弱,稀释后溶液中氢离子浓度越大,氢离子浓度越大,水的电离程度越小,则稀释后水电离出的c(H+)浓度较大的为HX,故B正确;
C.往10mL 0.1mol?L-1的Na2CO3溶液中缓慢滴加10mL 0.1mol?L-1的HX,反应生成碳酸氢钠和NaX,由于酸性HX>H2CO3,则cHCO3-的水解程度大于X-,溶液中离子浓度大小为:c(HCO3-)<c(X-),故C错误;
D.溶液为中性时,加入的氢氧化钠溶液体积偏小,氢氧化钠的物质的量小于醋酸,此时醋酸有剩余,没有完全反应,故D错误;
故选B.
点评:本题考查了酸碱混合的定性判断、溶液中离子浓度定性比较,题目难度中等,根据图象曲线变化正确判断HX与醋酸的酸性强弱为解答关键,注意掌握酸碱混合的定性判断方法,能够根据电荷守恒、盐的水解原理判断溶液中离子浓度大小.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法或表示方法中正确的是( )
| A、化学变化的实质是旧键的断裂和新键的生成,有物质变化但不一定有能量变化 |
| B、氢气的燃烧热为285.8kJ?mol-1,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=285.8kJ?mol-1 |
| C、Ba(OH)2?8H2O(s)+2NH4Cl(s)=BaCl2(s)+2NH3(g)+10H2O(l)△H<0 |
| D、已知中和热为57.3kJ?mol-1,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量要大于57.3kJ |
25℃时水的电离达到平衡:H2O?H++OH-:△H>0下列叙述正确的是( )
| A、向水中加入稀氨水,平衡逆向移动,c(H+)降低 |
| B、向水中加入少量固体醋酸钠,c(H+)增大,Kw不变 |
| C、向水中加入少量固体NH4Cl,平衡逆向移动,c(H+)降低 |
| D、将水加热,Kw增大,pH不变 |
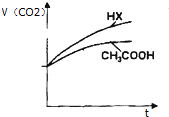
如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )

| A、若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 |
| B、若A为醋酸,B为贝壳,C中盛氯化钙溶液,则C中溶液变浑浊 |
| C、若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 |
| D、实验仪器D可以起到防止溶液倒吸的作用 |
 ,试根据下图所示的转化关系回答有关的问题(产物中生成的H2O等无机小分子均省略):
,试根据下图所示的转化关系回答有关的问题(产物中生成的H2O等无机小分子均省略):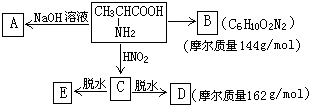
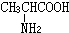 与
与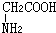 混合置于一反应容器中,一定条件下发生成肽反应,则最多生成
混合置于一反应容器中,一定条件下发生成肽反应,则最多生成