题目内容
下列图象表示将一种溶液或气体X,逐渐加入或通入另一种溶液Y中产生沉淀W与X物质的量的关系,从下表的各组物质中,找出与之相对应的图象,将标号(A~F)填入下面横线.

(1) (2) (3) (4) (5) (6) .

| 编号 | (1) | (2) | (3) | (4) | (5) | (6) |
| X Y | SO2 Ba(OH)2溶液 | 盐酸 NaAlO2溶液 | 氨水 AgNO3溶液 | NaAlO2溶液 盐酸 | NaOH溶液 AlCl3溶液 | AlCl3溶液 NaOH溶液 |
考点:二氧化硫的化学性质,氨的化学性质,镁、铝的重要化合物
专题:元素及其化合物
分析:(1)先发生SO2+Ba(OH)2=BaSO3↓+H2O,再通入SO2发生BaSO3↓+H2O+SO2=Ba(HCO3)2;
(2)先发生反应AlO2-+H++H2O=Al(OH)3↓,生成Al(OH)3沉淀,当偏铝酸钠溶液反应完后,再继续加入盐酸发生反应Al(OH)3+3H+═Al3++3H2O;
(3)氨水滴入AgNO3溶液中时发生的反应依次为AgNO3+NH3.H2O=AgOH↓+NH4NO3、AgOH+2NH3.H2O=[Ag(NH3)2]OH+2H2O;
(4)先发生AlO2-+4H+=Al3++2H2O,盐酸消耗完,再加NaAlO2溶液发生3AlO2-+Al3++6H2O=4Al(OH)3↓;
(5)先发生反应Al3++3OH-═Al(OH)3↓,生成Al(OH)3沉淀,当氯化铝溶液反应完后,再滴入氢氧化钠溶液发生反应Al(OH)3+NaOH═NaAlO2+2H2O沉淀溶解至最后消失;
(6)先发生反应Al3++4OH-═AlO2-+2H2O,不生成沉淀,当氢氧化钠溶液反应完后,再滴入氯化铝溶液发生反应后发生3AlO2-↓+Al3++6H2O═4Al(OH)3↓+6H2O.
(2)先发生反应AlO2-+H++H2O=Al(OH)3↓,生成Al(OH)3沉淀,当偏铝酸钠溶液反应完后,再继续加入盐酸发生反应Al(OH)3+3H+═Al3++3H2O;
(3)氨水滴入AgNO3溶液中时发生的反应依次为AgNO3+NH3.H2O=AgOH↓+NH4NO3、AgOH+2NH3.H2O=[Ag(NH3)2]OH+2H2O;
(4)先发生AlO2-+4H+=Al3++2H2O,盐酸消耗完,再加NaAlO2溶液发生3AlO2-+Al3++6H2O=4Al(OH)3↓;
(5)先发生反应Al3++3OH-═Al(OH)3↓,生成Al(OH)3沉淀,当氯化铝溶液反应完后,再滴入氢氧化钠溶液发生反应Al(OH)3+NaOH═NaAlO2+2H2O沉淀溶解至最后消失;
(6)先发生反应Al3++4OH-═AlO2-+2H2O,不生成沉淀,当氢氧化钠溶液反应完后,再滴入氯化铝溶液发生反应后发生3AlO2-↓+Al3++6H2O═4Al(OH)3↓+6H2O.
解答:
解:(1)先发生SO2+Ba(OH)2=BaSO3↓+H2O,再通入SO2发生BaSO3↓+H2O+SO2=Ba(HCO3)2,前后两个过程SO2的物质的量之比为1:1,图象E符合;
(2)先发生反应AlO2-+H++H2O=Al(OH)3↓,生成Al(OH)3沉淀,当偏铝酸钠溶液反应完后,再继续加入盐酸发生反应Al(OH)3+3H+═Al3++3H2O,前后两个过程HCl的物质的量之比为1:3,图象F符合;
(3)氨水滴入AgNO3溶液中时发生的反应依次为AgNO3+NH3.H2O=AgOH↓+NH4NO3、AgOH+2NH3.H2O=[Ag(NH3)2]OH+2H2O,先生成沉淀后沉淀消失,消耗NH3.H2O前后为1:2,图象均不符合;
(4)先发生AlO2-+4H+=Al3++2H2O,盐酸消耗完,再加NaAlO2溶液发生3AlO2-+Al3++6H2O=4Al(OH)3↓,先不生成沉淀,后生沉淀,且前后消耗NaAlO2溶液为1:3,图象C(或D)均符合;
(5)先发生反应Al3++3OH-═Al(OH)3↓,生成Al(OH)3沉淀,当氯化铝溶液反应完后,再滴入氢氧化钠溶液发生反应Al(OH)3+NaOH═NaAlO2+2H2O沉淀溶解至最后消失,前后两个过程氢氧化钠的物质的量之比为3:1,图象B符合;
(6)先发生反应Al3++4OH-═AlO2-+2H2O,不生成沉淀,当氢氧化钠溶液反应完后,再滴入氯化铝溶液发生反应后发生3AlO2-+Al3++6H2O═4Al(OH)3↓+6H2O,前后两个过程氯化铝的物质的量之比为3:1,图象A符合,
故答案为:E;F;均不符合;C(或D);B;A.
(2)先发生反应AlO2-+H++H2O=Al(OH)3↓,生成Al(OH)3沉淀,当偏铝酸钠溶液反应完后,再继续加入盐酸发生反应Al(OH)3+3H+═Al3++3H2O,前后两个过程HCl的物质的量之比为1:3,图象F符合;
(3)氨水滴入AgNO3溶液中时发生的反应依次为AgNO3+NH3.H2O=AgOH↓+NH4NO3、AgOH+2NH3.H2O=[Ag(NH3)2]OH+2H2O,先生成沉淀后沉淀消失,消耗NH3.H2O前后为1:2,图象均不符合;
(4)先发生AlO2-+4H+=Al3++2H2O,盐酸消耗完,再加NaAlO2溶液发生3AlO2-+Al3++6H2O=4Al(OH)3↓,先不生成沉淀,后生沉淀,且前后消耗NaAlO2溶液为1:3,图象C(或D)均符合;
(5)先发生反应Al3++3OH-═Al(OH)3↓,生成Al(OH)3沉淀,当氯化铝溶液反应完后,再滴入氢氧化钠溶液发生反应Al(OH)3+NaOH═NaAlO2+2H2O沉淀溶解至最后消失,前后两个过程氢氧化钠的物质的量之比为3:1,图象B符合;
(6)先发生反应Al3++4OH-═AlO2-+2H2O,不生成沉淀,当氢氧化钠溶液反应完后,再滴入氯化铝溶液发生反应后发生3AlO2-+Al3++6H2O═4Al(OH)3↓+6H2O,前后两个过程氯化铝的物质的量之比为3:1,图象A符合,
故答案为:E;F;均不符合;C(或D);B;A.
点评:本题考查元素化合物的性质及化学反应图象,为高频考点,明确发生的化学反应及反应与图象的对应关系是解答的关键,要求学生有将图象信息转换为化学信息的能力,同时对化学知识必须十分熟练,题目难度较大.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
下列中学常见化学反应中,既属于氧化还原反应又属于分解反应的是( )
| A、三氧化硫溶于水生成硫酸 |
| B、碳酸钙受热分解生成氧化钙和二氧化碳 |
| C、高锰酸钾受热发生反应制氧气 |
| D、过氧化钠中通入二氧化碳气体 |
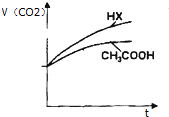 25℃时,将浓度均为0.1mol?L-1 CH3COOH溶液和HX溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,则下列说法正确的是( )
25℃时,将浓度均为0.1mol?L-1 CH3COOH溶液和HX溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,则下列说法正确的是( )| A、电离平衡常数:CH3COOH>HX>H2CO3 |
| B、将pH=2的CH3COOH溶液和HX溶液稀释10倍后,水电离出的c(H+)较大的为HX溶液 |
| C、往10mL 0.1mol?L-1的Na2CO3溶液中缓慢滴加10mL 0.1mol?L-1的HX,混合后的离子浓度大小关系为c(Na+)>c(HCO3-)>c(X-)>c(OH-)>c(H+) |
| D、当浓度均为0.1mol?L-1的CH3COOH溶液和HX的混合液用标准氢氧化钠溶液滴定至中性时,CH3COOH被完全中和 |
 :
:
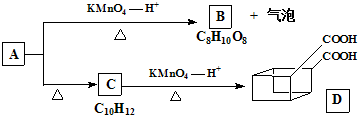
 某芳香化合物H常用作食用香精.用质谱法测得其相对分子质量为162,分子中C、H、O原子个数比为5:5:1.H只有一个支链;它能与溴的四氯化碳溶液发生加成反应.且在碱性条件下能发生水解反应,产物之一是甲醇.G是H的同分异构体.用芳香烃A为原料合成G的路线如图.
某芳香化合物H常用作食用香精.用质谱法测得其相对分子质量为162,分子中C、H、O原子个数比为5:5:1.H只有一个支链;它能与溴的四氯化碳溶液发生加成反应.且在碱性条件下能发生水解反应,产物之一是甲醇.G是H的同分异构体.用芳香烃A为原料合成G的路线如图.