题目内容
比较下列溶液的pH(填“大于”、“等于”、“小于”或“无法确定”)
(1)25℃时,0.1mol/LNa2CO3溶液 0.1mol/LNaHCO3溶液;
(2)25℃时,1mol/LFeCl3溶液 80℃时,1mol/LFeCl3溶液.
(1)25℃时,0.1mol/LNa2CO3溶液
(2)25℃时,1mol/LFeCl3溶液
考点:盐类水解的应用
专题:盐类的水解专题
分析:多元弱酸盐溶于水后,弱酸根离子分步水解,但第一步水解程度大于第二步水解程度,水解程度越大,溶液的碱性越强,盐类的水解是吸热反应,升高温度促进水解.
解答:
解:(1)碳酸根离子的水解程度大于碳酸氢根离子,水解程度越大,溶液的碱性越强,物质的量相同的碳酸钠和碳酸氢钠溶液,碳酸钠溶液的碱性大于碳酸氢钠溶液,即碳酸钠溶液的pH大于碳酸氢钠,故答案为:大于;
(2)氯化铁溶液水解呈酸性,盐类的水解是吸热反应,升高温度促进水解,所以25℃1mol/LFeCl3溶液小于80℃1mol/LFeCl3溶液的水解程度,即25℃1mol/LFeCl3溶液的pH大于80℃1mol/LFeCl3溶液的pH,故答案为:大于.
(2)氯化铁溶液水解呈酸性,盐类的水解是吸热反应,升高温度促进水解,所以25℃1mol/LFeCl3溶液小于80℃1mol/LFeCl3溶液的水解程度,即25℃1mol/LFeCl3溶液的pH大于80℃1mol/LFeCl3溶液的pH,故答案为:大于.
点评:本题考查了盐类的水解,难度不大,根据“谁弱谁水解”、“谁强谁显性”来分析解答即可,注意盐类的水解是吸热反应且能促进水电离.

练习册系列答案
相关题目
某温度时,N2+3H2
2NH3的平衡常数K=a,则此温度下,NH3
H2+
N2的平衡常数为( )
| 催化剂 |
| 催化剂 |
| 3 |
| 2 |
| 1 |
| 2 |
| A、a-1/2 | ||
B、
| ||
| C、a1/2 | ||
| D、a-2 |
下列中学常见化学反应中,既属于氧化还原反应又属于分解反应的是( )
| A、三氧化硫溶于水生成硫酸 |
| B、碳酸钙受热分解生成氧化钙和二氧化碳 |
| C、高锰酸钾受热发生反应制氧气 |
| D、过氧化钠中通入二氧化碳气体 |
下列物质中不属于有机物的是( )
| A、醋酸 | B、乙炔 | C、氯乙烷 | D、碳酸 |
常温下,pH=3的一元酸和pH=13的氢氧化钠溶液等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应.下列说法不正确的是( )
| A、两溶液混合反应后的所得的混合溶液呈碱性 |
| B、所用酸溶液的浓度大于所用氢氧化钠溶液的浓度 |
| C、若酸为醋酸,原醋酸溶液中有1%的醋酸已电离 |
| D、若酸为醋酸,反应后的溶液中CH3OO-与CH3COOH的平衡浓度之和约为0.05mol?L-1 |
在石墨的层状晶体里,每一层由无数个正六边形构成,每个碳原子与层内相邻的三个碳原子C-C键结合,等物质的量的石墨与金刚石中C-C键数之比是( )
| A、2:3 | B、2:1 |
| C、3:4 | D、1:1 |
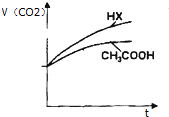 25℃时,将浓度均为0.1mol?L-1 CH3COOH溶液和HX溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,则下列说法正确的是( )
25℃时,将浓度均为0.1mol?L-1 CH3COOH溶液和HX溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,则下列说法正确的是( )| A、电离平衡常数:CH3COOH>HX>H2CO3 |
| B、将pH=2的CH3COOH溶液和HX溶液稀释10倍后,水电离出的c(H+)较大的为HX溶液 |
| C、往10mL 0.1mol?L-1的Na2CO3溶液中缓慢滴加10mL 0.1mol?L-1的HX,混合后的离子浓度大小关系为c(Na+)>c(HCO3-)>c(X-)>c(OH-)>c(H+) |
| D、当浓度均为0.1mol?L-1的CH3COOH溶液和HX的混合液用标准氢氧化钠溶液滴定至中性时,CH3COOH被完全中和 |
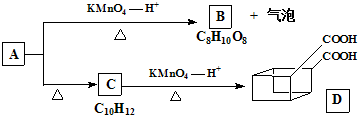
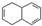 :
: 某芳香化合物H常用作食用香精.用质谱法测得其相对分子质量为162,分子中C、H、O原子个数比为5:5:1.H只有一个支链;它能与溴的四氯化碳溶液发生加成反应.且在碱性条件下能发生水解反应,产物之一是甲醇.G是H的同分异构体.用芳香烃A为原料合成G的路线如图.
某芳香化合物H常用作食用香精.用质谱法测得其相对分子质量为162,分子中C、H、O原子个数比为5:5:1.H只有一个支链;它能与溴的四氯化碳溶液发生加成反应.且在碱性条件下能发生水解反应,产物之一是甲醇.G是H的同分异构体.用芳香烃A为原料合成G的路线如图.