题目内容
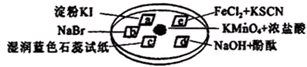
12.在一定温度下,密闭容器中可逆反应A(g)+3B(g)?2C(g)达到平衡的标志是( )| A. | C的反应速率与B的生成速率相等 | |
| B. | 单位时间内生成2n mol A,同时生成3n mol B | |
| C. | A、B、C的浓度不再变化 | |
| D. | A、B、C的浓度之比为1:3:2 |
分析 A、当用速率判断平衡状态时,要同时满足方向相反、数值与化学计量数要成正比例;
B、生成2nmolA,同时生成3n molB,方向相同,不能判断是否平衡;
C、达到平衡的标志是反应物和生成物组成不再发生变化;
D、达到平衡ABC的浓度比不一定是1:3:2,浓度比1:3:2,不能说明是否达到平衡.
解答 解:A、C的反应速率与B的生成速率,反应方向相同,数值未与计量数成正比例,不能判断平衡,故A错误;
B、生成2nmolA,同时生成3n molB,只是表示正反应情况,不知道逆反应的速率,故无法判断是否平衡,故B错误;
C、由于A、B、C的浓度不再变化,说明各种物质的生成速率和消耗速率相等,反应已经达到平衡状态,故C正确;
D、浓度之比不能说明正逆反应速率相等,故D错误;
故选C.
点评 本题考查判断达到化学平衡状态的依据,抓住各组分的浓度不再变化,正反应速率等于逆反应速率,本题难度中等.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
2.下表列出了①~⑨九种元素在周期表中的位置:
请按要求回答下列问题.
(1)元素④的名称是氧,元素④在周期表中所处位置第二周期第ⅥA族
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性PH3<H2S<H2O (写氢化物的化学式);
(3)元素⑦的原子结构示意图是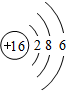 ;
;
(4)写出实验室制取③的氢化物的化学反应方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(5)用电子式表示①与⑨反应得到的化合物的形成过程 .
.
| ⅠA | ⅧA | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑧ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
(1)元素④的名称是氧,元素④在周期表中所处位置第二周期第ⅥA族
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性PH3<H2S<H2O (写氢化物的化学式);
(3)元素⑦的原子结构示意图是
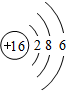 ;
;(4)写出实验室制取③的氢化物的化学反应方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(5)用电子式表示①与⑨反应得到的化合物的形成过程
 .
.
20.铪由于具有低的中子吸收截面,优异的耐蚀性能和加工性能,是核工业的重要材料.其中一种是${\;}_{72}^{185}$Hf铪),下列说法正确的是( )
| A. | ${\;}_{72}^{185}$Hf的质量数为72 | |
| B. | ${\;}_{72}^{185}$Hf的核外电子数为72 | |
| C. | ${\;}_{72}^{185}$Hf的中子数为103 | |
| D. | ${\;}_{72}^{185}$Hf与${\;}_{72}^{179}$Hf互为同素异形体 |
7.下列溶液中的离子一定能大量共存的是( )
| A. | 含大量Al3+的溶液中:Na+、K+、SO42-、HCO3- | |
| B. | 在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| C. | 含大量OH-的溶液中:Na+、NO3-、K+、AlO2- | |
| D. | 含大量Fe3+的溶液中:NH4+、Na+、I-、SCN- |
1.下列晶体中由原子直接构成的单质有( )
| A. | 硫 | B. | 生铁 | C. | 金刚石 | D. | 金属镁 |
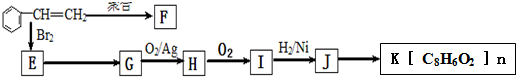
 ;J的分子式是C8H8O3.
;J的分子式是C8H8O3.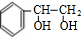 +O2$→_{△}^{Ag}$
+O2$→_{△}^{Ag}$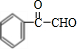 +2H2O;反应类型属于氧化反应
+2H2O;反应类型属于氧化反应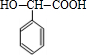 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$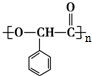 +n H2O
+n H2O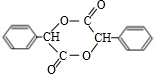 .
.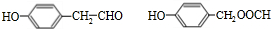 .
.