题目内容
下列说法正确的是( )
| A、1 mol物质的质量就是该物质的摩尔质量 |
| B、1 mol气体的体积就是气体摩尔体积 |
| C、1 mol任何粒子的相应粒子数叫做阿伏加德罗常数 |
| D、1 mol HCl溶于1 L水中,所得盐酸的物质的量浓度为1 mol?L-1 |
考点:阿伏加德罗常数,摩尔质量,气体摩尔体积,物质的量浓度
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.质量的单位为g,摩尔质量的单位为g/mol;
B.气体体积的单位为L,而气体摩尔体积的单位为L/mol;
C.根据阿伏伽德罗常数的标准进行分析;
D.氯化氢溶于水1L水中,所得溶液的体积不是1L.
B.气体体积的单位为L,而气体摩尔体积的单位为L/mol;
C.根据阿伏伽德罗常数的标准进行分析;
D.氯化氢溶于水1L水中,所得溶液的体积不是1L.
解答:
解:A.1 mol物质的质量的单位为g,而该物质的摩尔质量的单位为g/mol,二者单位不同,故A错误;
B.1mol气体的体积单位为L,而气体摩尔体积的单位为L/mol,二者的单位不相同,故B错误;
C.阿伏伽德罗常数为1mol粒子中含有的相应粒子数,故C正确;
D.1 mol HCl溶于1 L水中,所得溶液的体积不是1L,所得溶液的浓度不是1mol/L,故D错误;
故选C.
B.1mol气体的体积单位为L,而气体摩尔体积的单位为L/mol,二者的单位不相同,故B错误;
C.阿伏伽德罗常数为1mol粒子中含有的相应粒子数,故C正确;
D.1 mol HCl溶于1 L水中,所得溶液的体积不是1L,所得溶液的浓度不是1mol/L,故D错误;
故选C.
点评:本题考查了气体体积与摩尔体积、质量与摩尔质量、阿伏伽德罗常数、物质的量浓度的判断,题目难度不大,注意明确质量与摩尔质量、体积与摩尔体积之间的区别,选项D为易错点,注意所得溶液的体积不是1L.

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
某硫酸厂废气中SO2的回收利用方案如图所示.下列说法不正确的是( )


| A、X可能含有2种盐 |
| B、a是SO3 |
| C、Y可能含有(NH4)2SO4 |
| D、(NH4)2S2O8中S的化合价不可能为+7 |
下列离子方程式的书写符合前提所述的情况的是( )
| A、NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-→NH3↑+H2O |
| B、在NH4Al(SO4)2(一种复盐)的溶液中加入Ba(OH)2溶液至沉淀的质量达到最大时:Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+AlO2-+2H2O |
| C、当Ba(OH)2和NaHSO4 混合恰好呈中性:Ba2++2OH-+2H++SO42-→BaSO4↓+2H2O |
| D、向烧碱溶液中通入CO2,当n(NaOH):n(CO2)=3:2时:OH-+CO2→HCO3- |
水热法制备Fe3O4纳米颗粒的反应为3Fe2++2S2O32-+O2+xOH-→Fe3O4+S4O62-+2H2O,下列说法中,不正确的是( )
| A、每生成1mol Fe3O4,反应转移的电子总数为2mol | ||
| B、Fe2+和S2O32-都是还原剂 | ||
C、1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为
| ||
| D、x=4 |
对于N2(g)+3H2(g)?2NH3(g),不能作为反应达到平衡状态的判断依据是( )
| A、N2、H2、NH3的浓度不再发生变化 |
| B、恒容密闭容器中总压强不变 |
| C、生成氨气的速率与氨气分解的速率相等 |
| D、单位时间内生成1molN2,同时生成3molH2 |
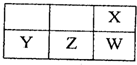 短周期元素X、Y、Z、W在周期表中的相对位置如图所示,Z的单质是常见的半导体材料.由此可知( )
短周期元素X、Y、Z、W在周期表中的相对位置如图所示,Z的单质是常见的半导体材料.由此可知( )| A、X、Z、W的简单氢化物的稳定性Z>W>X |
| B、W元素的单质在化学反应中只表现还原性 |
| C、X、Y的简单离子半径Y>X |
| D、Y、Z、W的最高价氧化物均能与NaOH溶液反应 |
三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2.其反应原理为:C3N3(OH)3
3HNCO;8HNCO+6NO2
7N2+8CO2+4H2O.
下列说法有错误的是( )
| △ |
| △ |
下列说法有错误的是( )
| A、C3N3(OH)3与HNCO虽最简式相同,但是两种不同的物质 |
| B、1mol HNCO与NO2反应时转移6mol电子 |
| C、HNCO是强还原剂 |
| D、N2既是氧化产物也是还原产物 |
131 55 |
| A、131 | B、76 | C、55 | D、21 |
下列表达正确的是( )
A、NaCl的电子式: |
B、CO2的分子模型示意图: |
C、CrO5的结构式为: 该氧化物中Cr为+6价 该氧化物中Cr为+6价 |
| D、次氯酸的结构式:H-Cl-O |