题目内容
现用如图所示的装置制取较多量的饱和氯水.
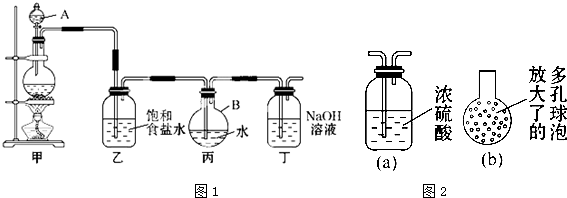
回答有关问题:
(1)写出有关反应的离子方程式.
装置甲: ;装置丁: .
(2)证明氯水已饱和的现象是 .
(3)制取结束时,装置丙的液体中含有最多的微粒是 (水分子除外);装置乙的作用是 .
(4)有如下改进措施或建议,请作出评价:
①在装置乙和丙之间增加如图(a)所示的装置,你认为有无必要? .
②在装置丙的长导管下口处,接如图(b)所示的多孔球泡,这样做的好处是 .

回答有关问题:
(1)写出有关反应的离子方程式.
装置甲:
(2)证明氯水已饱和的现象是
(3)制取结束时,装置丙的液体中含有最多的微粒是
(4)有如下改进措施或建议,请作出评价:
①在装置乙和丙之间增加如图(a)所示的装置,你认为有无必要?
②在装置丙的长导管下口处,接如图(b)所示的多孔球泡,这样做的好处是
考点:常见气体制备原理及装置选择,实验装置综合
专题:实验设计题
分析:(1)根据实验室制取氯气的反应原理解答;根据氯气能和碱反应反应氯化钠、次氯酸钠和水;
(2)根据饱和溶液中不能溶解氯气以及氯气为黄绿色来解答;
(3)根据氯水中成分来分析;根据饱和食盐水来除去氯气中的氯化氢;
(4)①根据氯气中含水对制备氯水无影响;
②根据多孔球泡的表面积大,能加快溶解的速率.
(2)根据饱和溶液中不能溶解氯气以及氯气为黄绿色来解答;
(3)根据氯水中成分来分析;根据饱和食盐水来除去氯气中的氯化氢;
(4)①根据氯气中含水对制备氯水无影响;
②根据多孔球泡的表面积大,能加快溶解的速率.
解答:
解:(1)实验室制取氯气的反应原理:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,离子方程式为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,氯气能和碱反应反应氯化钠、次氯酸钠和水,化学方程式为:2NaOH+Cl2=NaCl+NaClO+H2O,离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O,
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;2OH-+Cl2=Cl-+ClO-+H2O;
(2)因饱和溶液中不能溶解氯气以及氯气为黄绿色,所以丙中的导管有气泡溢出水面,且液面上方充满黄绿色气体即可证明氯水已饱和,
故答案为:丙中的导管有气泡溢出水面,且液面上方充满黄绿色气体;
(3)由氯水中成分可知,氯水中含有最多的微粒除了水就是氯气;饱和食盐水来除去氯气中的氯化氢;
故答案为:Cl2;除去氯气中的氯化氢;
(4)①因氯气中含水对制备氯水无影响,所以在装置乙和丙之间不需要增加如图2(a)所示的装置;
故答案为:无;
②因多孔球泡的表面积大,能加快氯气溶解的速率,
故答案为:增加氯气与水的接触面积,利于氯气溶解.
| ||
| ||
故答案为:MnO2+4H++2Cl-
| ||
(2)因饱和溶液中不能溶解氯气以及氯气为黄绿色,所以丙中的导管有气泡溢出水面,且液面上方充满黄绿色气体即可证明氯水已饱和,
故答案为:丙中的导管有气泡溢出水面,且液面上方充满黄绿色气体;
(3)由氯水中成分可知,氯水中含有最多的微粒除了水就是氯气;饱和食盐水来除去氯气中的氯化氢;
故答案为:Cl2;除去氯气中的氯化氢;
(4)①因氯气中含水对制备氯水无影响,所以在装置乙和丙之间不需要增加如图2(a)所示的装置;
故答案为:无;
②因多孔球泡的表面积大,能加快氯气溶解的速率,
故答案为:增加氯气与水的接触面积,利于氯气溶解.
点评:本题主要考查了饱和氯水的制备、离子方程式的书写、实验装置作用,题目难度中等,掌握实验室制取氯气的原理和注意事项是解题的关键.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
下列化学方程式或离子方程式正确的是( )
| A、乙酸与碳酸钙固体反应的离子方程式:2H++CaCO3=Ca2++CO2↑+H2O |
B、苯酚钠溶液中通入少量二氧化碳的离子方程式: |
C、制备酚醛树脂的化学方程式: |
D、丙烯聚合成聚丙烯的化学方程式: |
 丙烷进行氯代反应中,可分离出4种二氯代物A、B、C、D,分子式均为C3H6Cl2.当它们进一步氯代为三氯代物时,A只有一种三氯代物,B有2种三氯代物,C和D各有3种三氯代物,已知C具有不对称碳原子,试写出A、B、C、D的结构简式:A
丙烷进行氯代反应中,可分离出4种二氯代物A、B、C、D,分子式均为C3H6Cl2.当它们进一步氯代为三氯代物时,A只有一种三氯代物,B有2种三氯代物,C和D各有3种三氯代物,已知C具有不对称碳原子,试写出A、B、C、D的结构简式:A