题目内容
某有机物蒸汽对氢气的相对密度为38,现取7.6g该有机物完全燃烧,将全部产物依次通入足量的浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重8.8g,求:
(1)该有机物的相对分子质量为
(2)此有机物分子式 .
(1)该有机物的相对分子质量为
(2)此有机物分子式
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:(1)气体飞密度与摩尔质量成正比,根据有机物蒸汽对氢气的相对密度为38计算出该有机物的相对分子量;
(2)浓硫酸增重的为水的质量、碱石灰增重的为二氧化碳的质量,据此计算出水和二氧化碳的物质的量,根据质量守恒判断是否含有氧元素,如何计算出氧元素的物质的量,根据有机物的物质的量、C、H、O元素的物质的量确定该有机物的分子式.
(2)浓硫酸增重的为水的质量、碱石灰增重的为二氧化碳的质量,据此计算出水和二氧化碳的物质的量,根据质量守恒判断是否含有氧元素,如何计算出氧元素的物质的量,根据有机物的物质的量、C、H、O元素的物质的量确定该有机物的分子式.
解答:
解:(1)该有机物蒸汽对氢气的相对密度为38,则该有机物的摩尔质量为2g/mol×38=76g/mol,该有机物的相对分子量为76,
故答案为:76;
(2)碱石灰增重8.8g为二氧化碳的质量,二氧化碳的物质的量为:n(CO2)=
=0.2mol,含有碳原子质量为:m(C)=12g/mol×0.2mol=2.4g,
浓硫酸增重3.6g为水的质量,水的物质的量为:n(H2O)=
=0.2mol,0.2mol水中含有0.4molH原子,含氢元素的质量为:1g/mol×0.4mol=0.4g,
7.6g有机物分子中含有C、H元素的质量为:2.4g+0.4g=2.8g<7.6g,该有机物中一定含有O原子,含有氧原子的质量为:7.6g-2.8g=4.8g,
含有氧原子的物质的量为:n(O)=
=0.3mol,
7.6g该有机物的物质的量为:
=0.1mol,
该有机物分子中含有C、H、O原子的数目分别为:
=2、
=4、
=3,
所以该有机物的分子式为:C2H4O3,
故答案为:C2H4O3.
故答案为:76;
(2)碱石灰增重8.8g为二氧化碳的质量,二氧化碳的物质的量为:n(CO2)=
| 8.8g |
| 44g/mol |
浓硫酸增重3.6g为水的质量,水的物质的量为:n(H2O)=
| 3.6g |
| 18g/mol |
7.6g有机物分子中含有C、H元素的质量为:2.4g+0.4g=2.8g<7.6g,该有机物中一定含有O原子,含有氧原子的质量为:7.6g-2.8g=4.8g,
含有氧原子的物质的量为:n(O)=
| 4.8g |
| 16g/mol |
7.6g该有机物的物质的量为:
| 7.6g |
| 76g/mol |
该有机物分子中含有C、H、O原子的数目分别为:
| 0.2mol |
| 0.1mol |
| 0.4mol |
| 0.1mol |
| 0.3mol |
| 0.1mol |
所以该有机物的分子式为:C2H4O3,
故答案为:C2H4O3.
点评:本题考查了有机物分子式的方法,题目难度中等,注意掌握常见有机物分子式的方法,解题的关键是根据质量守恒判断有机物分子中含有氧原子的情况.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
 ,
, ,
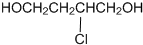
,

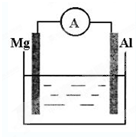 如图所示,组成一个原电池.
如图所示,组成一个原电池.