题目内容
下列离子方程式书写正确的是( )
| A、少量的金属钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ |
| B、铝片投入稀盐酸中:Al+6H+═Al3++3H2↑ |
| C、氢氧化钡溶液与稀硫酸混合:Ba2++SO42-═BaSO4↓ |
| D、氧化铝溶于烧碱溶液:Al2O3+2OH-═AlO2-+H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.钠与水反应生成氢氧化钠和氢气;
B.电荷不守恒;
C.漏掉氢离子与氢氧根离子的反应;
D.原子个数不守恒.
B.电荷不守恒;
C.漏掉氢离子与氢氧根离子的反应;
D.原子个数不守恒.
解答:
解:A.少量的金属钠投入水中,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故A正确;
B.铝片投入稀盐酸中,离子方程式:2Al+6H+═2Al3++3H2↑,故B错误;
C.氢氧化钡溶液与稀硫酸混合,离子方程式:2H++2OH-+Ba2++SO42-═BaSO4↓+2H2O,故C错误;
D.氧化铝溶于烧碱溶液,离子方程式:Al2O3+2OH-═2AlO2-+H2O,故D错误;
故选:A.
B.铝片投入稀盐酸中,离子方程式:2Al+6H+═2Al3++3H2↑,故B错误;
C.氢氧化钡溶液与稀硫酸混合,离子方程式:2H++2OH-+Ba2++SO42-═BaSO4↓+2H2O,故C错误;
D.氧化铝溶于烧碱溶液,离子方程式:Al2O3+2OH-═2AlO2-+H2O,故D错误;
故选:A.
点评:本题难度不是很大,考查离子方程式的书写,解题时注意从化学式、离子符号、电荷守恒、是否符合反应实际的角度分析离子方程式的书写是否正确.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
工业上热水瓶胆镀银常用的还原剂是( )
| A、乙醛 | B、葡萄糖 |
| C、麦芽糖 | D、银氨溶液 |
铁和铁合金是生活中常用的材料,下列说法正确的是( )
| A、不锈钢是铁合金,只含金属元素 |
| B、一定条件下,铁粉可与水蒸气反应 |
| C、铁与盐酸反应,铁合金不与盐酸反应 |
| D、铁合金的硬度和强度均低于铁 |
下列说法不正确的是( )
| A、多孔碳可用作氢氧燃料电池的电极材料 |
| B、油脂的皂化反应生成脂肪酸和丙醇 |
| C、盐析可提纯蛋白质并保持其生理活性 |
| D、1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子(NA表示阿伏加德罗常数) |
下列金属的冶炼适宜用热还原法冶炼的是( )
| A、钠 | B、铝 | C、汞 | D、铁 |
在指定条件下,下列各组离子一定能够大量共存的是( )
| A、能使甲基橙变黄的溶液中:Al3+、Na+、SO42-、CO32- | ||
| B、能与铝反应产生氢气的溶液:Na+、Fe2+、Cl-、NO3- | ||
C、
| ||
| D、由水电离的c(H+)=1.0×10-13 mol?L-1的溶液中:K+、NH4+、AlO2-、HCO3- |
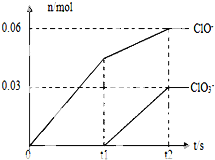 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )| A、苛性钾溶液中KOH的物质的量是0.09mol |
| B、ClO3-的生成是由于氯气的量的多少引起的 |
| C、在酸性条件下,ClO-和ClO3-可生成Cl2 |
| D、反应中转移电子的物质的量是0.21mol |