题目内容
下表中的实线表示元素周期表的部分边界.①~⑩分别表示元素周期表中对应位置的元素.
(1)请在上表中用直尺画实线补全元素周期表边界及金属与非金属分界线.
(2)⑥、⑦、⑧、⑨的原子半径由大到小的顺序是 (填元素符号).
(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被MnO2、FeCl3等催化分解,写出该化合物的电子式: .
(4)⑨、⑩最高价氧化物对应的水化物可以反应,该反应的离子方程式 .
(5)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑨的氢氧化物有相似的性质.写出元素③的氢氧化物与NaOH溶液反应的化学方程式: .
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ||||||||||||
| ⑧ | ⑨ | ⑩ | |||||||||||||||
(2)⑥、⑦、⑧、⑨的原子半径由大到小的顺序是
(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被MnO2、FeCl3等催化分解,写出该化合物的电子式:
(4)⑨、⑩最高价氧化物对应的水化物可以反应,该反应的离子方程式
(5)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑨的氢氧化物有相似的性质.写出元素③的氢氧化物与NaOH溶液反应的化学方程式:
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知①为H、②为Li、③为Be、④为B、⑤为N、⑥为O、⑦为F、⑧为Mg、⑨为Al、⑩为S.
(1)第一周期都是非金属元素,分别处于第1、18列,其它周期中最外层电子数≤周期数的元素为金属元素;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被MnO2、FeCl3等催化分解,该化合物为H2O2,分子中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对;
(4)⑨、⑩最高价氧化物对应的水化物分别为氢氧化铝、硫酸,二者反应生成硫酸铝与水;
(5)元素Be与元素Al的氢氧化物有相似的性质,则Be(OH)2与NaOH溶液反应生成NaBeO2与水.
(1)第一周期都是非金属元素,分别处于第1、18列,其它周期中最外层电子数≤周期数的元素为金属元素;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被MnO2、FeCl3等催化分解,该化合物为H2O2,分子中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对;
(4)⑨、⑩最高价氧化物对应的水化物分别为氢氧化铝、硫酸,二者反应生成硫酸铝与水;
(5)元素Be与元素Al的氢氧化物有相似的性质,则Be(OH)2与NaOH溶液反应生成NaBeO2与水.
解答:
解:由元素在周期表中位置,可知①为H、②为Li、③为Be、④为B、⑤为N、⑥为O、⑦为F、⑧为Mg、⑨为Al、⑩为S.
(1)第一周期都是非金属元素,分别处于第1、18列,其它周期中最外层电子数≤周期数的元素为金属元素,实线补全元素周期表边界及金属与非金属分界线为: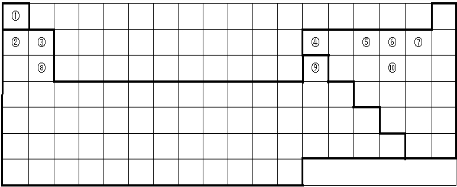 ;
;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Mg>Al>O>F,故答案为:Mg>Al>O>F;
(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被MnO2、FeCl3等催化分解,该化合物为H2O2,分子中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对,其电子式为: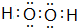 ,故答案为:
,故答案为: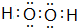 ;
;
(4)⑨、⑩最高价氧化物对应的水化物分别为氢氧化铝、硫酸,二者反应生成硫酸铝与水,反应离子方程式为:Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O;
(5)元素Be与元素Al的氢氧化物有相似的性质,则Be(OH)2与NaOH溶液反应生成Na2BeO2与水,反应方程式为:Be(OH)2+2NaOH=Na2BeO2+2H2O,故答案为:Be(OH)2+2NaOH=Na2BeO2+2H2O.
(1)第一周期都是非金属元素,分别处于第1、18列,其它周期中最外层电子数≤周期数的元素为金属元素,实线补全元素周期表边界及金属与非金属分界线为:
 ;
;(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Mg>Al>O>F,故答案为:Mg>Al>O>F;
(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被MnO2、FeCl3等催化分解,该化合物为H2O2,分子中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对,其电子式为:
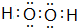 ,故答案为:
,故答案为: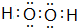 ;
;(4)⑨、⑩最高价氧化物对应的水化物分别为氢氧化铝、硫酸,二者反应生成硫酸铝与水,反应离子方程式为:Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O;
(5)元素Be与元素Al的氢氧化物有相似的性质,则Be(OH)2与NaOH溶液反应生成Na2BeO2与水,反应方程式为:Be(OH)2+2NaOH=Na2BeO2+2H2O,故答案为:Be(OH)2+2NaOH=Na2BeO2+2H2O.
点评:本题考查元素周期表与元素周期律综合应用,题目基础性强,注意整体把握元素周期表的结构,(5)中注意根据氢氧化铝进行知识迁移.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、少量的金属钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ |
| B、铝片投入稀盐酸中:Al+6H+═Al3++3H2↑ |
| C、氢氧化钡溶液与稀硫酸混合:Ba2++SO42-═BaSO4↓ |
| D、氧化铝溶于烧碱溶液:Al2O3+2OH-═AlO2-+H2O |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、1mol Na2O2固体中含离子总数为4NA | ||
| B、标准状况下,22.4L己烷中共价键数目为19NA | ||
| C、由乙烯和环己烷组成的混合物28g,含电子数为16NA | ||
D、1L浓度为1mol/L的Na2CO3溶液中含有的
|
实验室的钠着火燃烧时,可用下列哪种物质灭火( )
| A、水 | B、沙土 |
| C、泡沫灭火器 | D、干粉灭火器 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、25℃,1.01×105 Pa,64g SO2中含有的原子数为3NA |
| B、在常温常压下,11.2L Cl2含有的分子数为0.5NA |
| C、含有NA个氩原子的氩气在标准状况下的体积约为11.2L |
| D、标准状况下,11.2L H2O2含有的分子数为0.5NA |
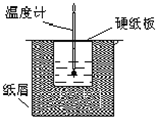 中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题: (1)下列实验操作或对实验事实的描述正确的有
(1)下列实验操作或对实验事实的描述正确的有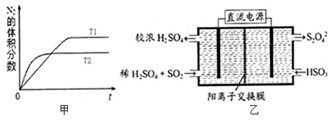 为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要.