题目内容
6.下列说法正确的是( )| A. | 用浓硝酸与Cu反应制NO2 | B. | 实验室用NH4Cl和Ca(OH)2制备NH3 | ||
| C. | NO2溶于水时发生氧化还原反应 | D. | 过量的铜与浓硝酸反应有N0生成 |
分析 A.浓硝酸与铜发生反应可以生成二氧化氮气体;
B.实验室中用加热氯化铵和氢氧化钙的混合物的方法获得氨气;
C.二氧化氮与水反应生成硝酸和NO;
D.铜与浓硝酸反应生成的是二氧化氮,铜与稀硝酸反应生成NO.
解答 解:A.铜与浓硝酸反应生成硝酸铜、二氧化氮气体 和水,可以用浓硝酸与铜反应获得少量二氧化氮,故A正确;
B.加热氯化铵和氢氧化钙的混合物可以生成氨气,实验室用该方法制取氨气,故B正确;
C.二氧化氮与水发生反应生成硝酸和NO气体,反应中存在化合价变化,属于氧化还原反应,故C正确;
D.过量的铜与浓硝酸混合时,Cu和浓硫酸反应生成NO2,但硝酸浓度达到一定程度后,Cu和硝酸反应生成NO,故D正确;
故选ABCD.
点评 本题考查了氧化还原反应、实验方案的设计与评价,题目难度不大,明确常见气体的性质及制备原理为解答关键,注意掌握氧化还原反应的概念及判断方法,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
16.向含有0.2molFeI2的溶液中加入a molBr2.下列叙述不正确的是( )
| A. | 当a=0.1时,发生的反应为2I-+Br2═I2+2Br- | |
| B. | 当a=0.25时,发生的反应为2Fe2++4I-+3Br2═2Fe3++2I2+6Br- | |
| C. | 当溶液中I-有一半被氧化时,c(I-):c(Br-)=1:1 | |
| D. | 当0.2<a<0.3时,溶液中各离子浓度的关系为2c(Fe2+)+3c(Fe3+)+c(H+)═c(Br-)+c(OH-) |
17.四种短周期元素X、Y、Z、W,已知X、Y的阳离子aXn+、bY(n+1)+电子层结构与Z、W的阴离子cZm-、dW(m+1)-电子层结构相同.下列叙述正确的是( )
| A. | 最高价氧化物对应水化物的碱性大小顺序一定是:X>Y | |
| B. | 离子半径和原子半径由大到小的顺序均为X>Y>Z>W | |
| C. | 氢化物的稳定性是Z>W;氢化物的沸点是Z<W | |
| D. | 还原性Zm->W(m+1)-,氧化性Xn+>Y(n+1)+ |
14.用相对分子质量为57的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物有( )
| A. | 4种 | B. | 8种 | C. | 10种 | D. | 12种 |
18.合成高分子材料PC的反应如图所示,下列说法不正确的是( )
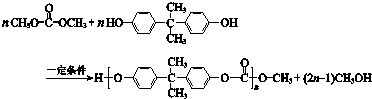

| A. | PC含有酯基 | |
| B. | 合成PC的反应为缩聚反应 | |
| C. | 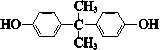 与 与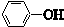 互为同系物 互为同系物 | |
| D. | 1 mol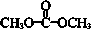 最多能与2 mol NaOH完全反应 最多能与2 mol NaOH完全反应 |