题目内容
0.05mol烃A完全燃烧,生成的气体通过浓硫酸后,浓硫酸增重5.4克,再通过KOH溶液后,KOH溶液增重19.8克,(设浓硫酸和KOH溶液的吸收率为100%).
(1)通过计算确定A的分子式.(写出计算过程)
(2)若0.1molA的氧化产物(被酸性高锰酸钾氧化)恰好2mol/L 100mL的NaOH溶液完全中和.写出A可能的结构简式.
(3)若A的核磁共振氢谱中只有2种峰,则写出A的结构简式.
(1)通过计算确定A的分子式.(写出计算过程)
(2)若0.1molA的氧化产物(被酸性高锰酸钾氧化)恰好2mol/L 100mL的NaOH溶液完全中和.写出A可能的结构简式.
(3)若A的核磁共振氢谱中只有2种峰,则写出A的结构简式.
考点:有机物实验式和分子式的确定,有机物的推断
专题:烃及其衍生物的燃烧规律
分析:(1)浓硫酸具有吸水性,增重5.4g,为水的质量,可求得烃中H原子个数,生成物通入KOH溶液,增重的质量为二氧化碳的质量,可求得烃中C原子个数,以此可求得烃的分子式;
(2)根据烃被酸性高锰酸钾氧化产物和氢氧化钠反应,可知A为苯的同系物,有两个取代基被氧化,据此写出结构简式;
(3)若A的核磁共振氢谱中只有2种峰,则有两种氢原子,据此写结构简式.
(2)根据烃被酸性高锰酸钾氧化产物和氢氧化钠反应,可知A为苯的同系物,有两个取代基被氧化,据此写出结构简式;
(3)若A的核磁共振氢谱中只有2种峰,则有两种氢原子,据此写结构简式.
解答:
解:(1)浓硫酸具有吸水性,增重5.4g,为水的质量,
则n(H2O)=
=0.3mol,n(H)=2n(H2O)=2×0.3mol=0.6mol,
即0.05mol烃中含有0.6molH原子,
所以该烃分子中H原子个数为12,
生成物通入KOH溶液,增重的19.8g质量为二氧化碳的质量,
则n(CO2)=
=0.45mol,n(C)=n(CO2)=0.45mol,
即0.05mol烃中含有0.45molC原子,
所以该烃分子中C原子个数为9,
所以该烃的分子式为C9H12,
答:该烃的分子式为C5H12.
(2)若0.1molA的氧化产物(被酸性高锰酸钾氧化)恰好2mol/L 100mL的NaOH溶液完全中和,可知有两个烷基被高锰酸钾氧化,为甲乙苯,有邻间对三种,故结构简式为:
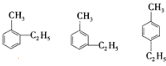 ,
,
答:A的结构简式为: ;
;
(3)若A的核磁共振氢谱中只有2种峰,则有两种氢,为均三甲苯,结构简式为: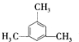 ,
,
答:A的结构简式为: .
.
则n(H2O)=
| 5.4g |
| 18g/mol |
即0.05mol烃中含有0.6molH原子,
所以该烃分子中H原子个数为12,
生成物通入KOH溶液,增重的19.8g质量为二氧化碳的质量,
则n(CO2)=
| 19.8g |
| 44g/mol |
即0.05mol烃中含有0.45molC原子,
所以该烃分子中C原子个数为9,
所以该烃的分子式为C9H12,
答:该烃的分子式为C5H12.
(2)若0.1molA的氧化产物(被酸性高锰酸钾氧化)恰好2mol/L 100mL的NaOH溶液完全中和,可知有两个烷基被高锰酸钾氧化,为甲乙苯,有邻间对三种,故结构简式为:
 ,
,答:A的结构简式为:
 ;
;(3)若A的核磁共振氢谱中只有2种峰,则有两种氢,为均三甲苯,结构简式为:
 ,
,答:A的结构简式为:
 .
.
点评:本题考查有机物分子式的确定和同分异构体的书写,题目难度不大,注意把握题中信息.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
如图显示了人类发展史上经济发展阶段与环境质量之间的关系.据图回答:根据这种关系,发展中国家应认识到( )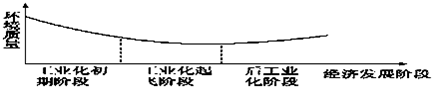

| A、环境污染不可避免,只能采取“先污染,后治理”的策略 |
| B、后工业化阶段环境问题会自然解决 |
| C、保护环境至关重要,必须杜绝兴建产生污染的工业设施 |
| D、应当采取措施减少或避免发展过程中的环境污染问题 |
相同温度下,甲(恒容)、乙(恒压)、丙(恒容)3个密闭容器中发生可逆反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.实验测得起始、平衡时的有关数据如下表.下列正确的是( )
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | ||
| SO2 | O2 | Ar | ||
| 甲 | 2 | 1 | 0 | 放出热量:Q1 |
| 乙 | 2 | 1 | 0 | 放出热量:Q2 |
| 丙 | 2 | 1 | 0.5 | 放出热量:Q3 |
| A、Q1=Q3<Q2 |
| B、达到平衡时,乙容器中SO2的体积分数最大 |
| C、平衡时,甲、乙、丙3个容器中甲的平衡常数最小 |
| D、若在上述条件下,反应生成1mol SO3(s),则反应放热为98.5kJ |
如图是实验室用电石和水反应制取乙炔的装嚣.其正确的是( )
A、 |
B、 |
C、 |
D、 |
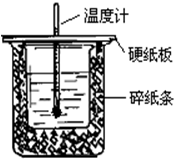 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 镁在空气中燃烧除生成MgO外,还可能生成Mg3N2.某校化学兴趣小组的同学利用镁在空气中燃烧后的固体(不含单质)进行实验,探究其组成.
镁在空气中燃烧除生成MgO外,还可能生成Mg3N2.某校化学兴趣小组的同学利用镁在空气中燃烧后的固体(不含单质)进行实验,探究其组成. 某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.
某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2. 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.