题目内容
由SiO2和CaCO3组成的混合物26.0g经灼烧至质量恒定时,其质量减少8.80g,试解答:
(1)写出可能发生反应的化学方程式.
(2)求产生的气体在标准状况下的体积.
(3)求原混合物中SiO2的质量.
(1)写出可能发生反应的化学方程式.
(2)求产生的气体在标准状况下的体积.
(3)求原混合物中SiO2的质量.
考点:有关混合物反应的计算
专题:计算题
分析:(1)碳酸钙与二氧化硅反应生成硅酸钙与二氧化碳,若碳酸钙过量,则碳酸钙分解为氧化钙与二氧化碳;
(2)混合物中碳元素完全转化到二氧化碳中,质量减少为生成二氧化碳的质量,根据n=
计算二氧化碳物质的量,再根据V=nVm计算其体积;
(3)根据碳元素守恒计算碳酸钙的质量,进而计算二氧化硅的质量.
(2)混合物中碳元素完全转化到二氧化碳中,质量减少为生成二氧化碳的质量,根据n=
| m |
| M |
(3)根据碳元素守恒计算碳酸钙的质量,进而计算二氧化硅的质量.
解答:
解:(1)碳酸钙与二氧化硅反应生成硅酸钙与二氧化碳,若碳酸钙过量,则碳酸钙分解为氧化钙与二氧化碳,可能发生的反应为:CaCO3+SiO2
CaSiO3+CO2↑,CaCO3
CaO+CO2↑,
答:可能发生的反应有:CaCO3+SiO2
CaSiO3+CO2↑,CaCO3
CaO+CO2↑;
(2)由方程式可知,混合物中碳元素完全转化到二氧化碳中,质量减少为生成二氧化碳的质量,故二氧化碳物质的量为
=0.2mol,标况下,二氧化碳的体积为0.2mol×22.4L/mol=4.48L,
答:生成气体的体积为4.48L;
(3)根据碳元素守恒,可知n(CaCO3)=n(CO2)=0.2mol,故m(CaCO3)=0.2mol×100g/mol=20g,故混合物中SiO2的质量为26.0g-20g=6.0g,
答:原混合物中SiO2的质量为6.0g.
| ||
| ||
答:可能发生的反应有:CaCO3+SiO2
| ||
| ||
(2)由方程式可知,混合物中碳元素完全转化到二氧化碳中,质量减少为生成二氧化碳的质量,故二氧化碳物质的量为
| 8.8g |
| 44g/mol |
答:生成气体的体积为4.48L;
(3)根据碳元素守恒,可知n(CaCO3)=n(CO2)=0.2mol,故m(CaCO3)=0.2mol×100g/mol=20g,故混合物中SiO2的质量为26.0g-20g=6.0g,
答:原混合物中SiO2的质量为6.0g.
点评:本题考查混合物计算,难度中等,关键是根据方程式判断固体质量减少为生成二氧化碳的质量.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
一定温度和压强下N2+3H2?2NH3反应达到平衡后,下列说法中正确的是( )
| A、N2与H2不再化合,NH3不再分解 |
| B、N2、H2化合成氨的反应速率等于NH3 分解的反应速率 |
| C、H2、NH3的体积分数相等 |
| D、N2、H2、NH3的物质的量浓度相等 |
0.1moL的某羧酸完全燃烧时,产生二氧化碳和水共3.4mol,该羧酸是( )
| A、C15H27COOH |
| B、C15H31COOH |
| C、C17H31COOH |
| D、C17H33COOH |
某金属能与盐酸反应产生氢气,该金属与锌组成的原电池中,锌为负极.该金属为( )
| A、铝 | B、铜 | C、铁 | D、镁 |
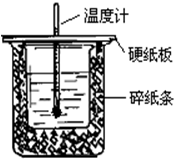 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: