题目内容
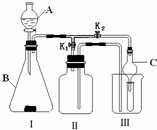 某研究性学习小组设计的实验装置(如图),既可用于制取气体,又可用于验证物质性质.
某研究性学习小组设计的实验装置(如图),既可用于制取气体,又可用于验证物质性质.(1)写出仪器A和B的名称:A:
(2)当打开K1、关闭K2时,利用Ⅰ、Ⅱ装置可直接进行的实验是
①大理石与稀盐酸反应制取二氧化碳
②锌与稀硫酸反应制取氢气
小明认为在不改变Ⅰ、Ⅱ装置的仪器及位置的前提下,该装置可用于双氧水制取氧气,他的做法是
实验室还可以用高锰酸钾制取氧气,化学方程式为
(3)当打开K2、关闭K1时,利用Ⅰ、Ⅲ装置可验证二氧化碳与水反应,生成了碳酸,此时试管中盛放的物质是
考点:常见气体制备原理及装置选择
专题:实验题
分析:(1)根据实验室常用仪器判断;
(2)实验室是用锌与稀硫酸反应制取氢气的;是用石灰石和稀盐酸来制取二氧化碳的,因此不需要加热.根据装置II,进入气体的导管比较短,因此可以用来收集氢气;该装置还可用于双氧水制取氧气,由于氧气的密度比空气大,因此装置II需要改进,改用排水法收集氧气;并根据高锰酸钾制氧气反应原理书写方程式;
(3)验证二氧化碳与水反应生成碳酸常用紫色石蕊试液.
(2)实验室是用锌与稀硫酸反应制取氢气的;是用石灰石和稀盐酸来制取二氧化碳的,因此不需要加热.根据装置II,进入气体的导管比较短,因此可以用来收集氢气;该装置还可用于双氧水制取氧气,由于氧气的密度比空气大,因此装置II需要改进,改用排水法收集氧气;并根据高锰酸钾制氧气反应原理书写方程式;
(3)验证二氧化碳与水反应生成碳酸常用紫色石蕊试液.
解答:
解:(1)根据实验室常用仪器判断,A为分液漏斗,B为锥形瓶;
故答案为:分液漏斗;锥形瓶;
(2)由于装置II中,进入气体的导管比较短,因此只能收集密度比空气小的气体,故可利用锌与稀硫酸反应制取氢气;
要收集氧气就必须在装置II中装满水后再进行制取.用高锰酸钾制取氧气时,高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,方程式是2KMnO4
K2MnO4+MnO2+O2↑;
故答案为:②;在装置II中装满水后再进行制取;2KMnO4
K2MnO4+MnO2+O2↑;
(3)当打开K2、关闭K1时,可验证二氧化碳的性质,二氧化碳与水反应生成碳酸,碳酸能使紫色石蕊试液变成红色.
故答案为:紫色石蕊试液;紫色石蕊试液变红.
故答案为:分液漏斗;锥形瓶;
(2)由于装置II中,进入气体的导管比较短,因此只能收集密度比空气小的气体,故可利用锌与稀硫酸反应制取氢气;
要收集氧气就必须在装置II中装满水后再进行制取.用高锰酸钾制取氧气时,高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,方程式是2KMnO4
| ||
故答案为:②;在装置II中装满水后再进行制取;2KMnO4
| ||
(3)当打开K2、关闭K1时,可验证二氧化碳的性质,二氧化碳与水反应生成碳酸,碳酸能使紫色石蕊试液变成红色.
故答案为:紫色石蕊试液;紫色石蕊试液变红.
点评:本考点考查了仪器的名称、二氧化碳的性质,气体的制取装置的选择与反应物的状态和反应的条件有关,气体的收集装置的选择与气体的密度和溶解性有关.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
相同温度下,甲(恒容)、乙(恒压)、丙(恒容)3个密闭容器中发生可逆反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.实验测得起始、平衡时的有关数据如下表.下列正确的是( )
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | ||
| SO2 | O2 | Ar | ||
| 甲 | 2 | 1 | 0 | 放出热量:Q1 |
| 乙 | 2 | 1 | 0 | 放出热量:Q2 |
| 丙 | 2 | 1 | 0.5 | 放出热量:Q3 |
| A、Q1=Q3<Q2 |
| B、达到平衡时,乙容器中SO2的体积分数最大 |
| C、平衡时,甲、乙、丙3个容器中甲的平衡常数最小 |
| D、若在上述条件下,反应生成1mol SO3(s),则反应放热为98.5kJ |
一定温度和压强下N2+3H2?2NH3反应达到平衡后,下列说法中正确的是( )
| A、N2与H2不再化合,NH3不再分解 |
| B、N2、H2化合成氨的反应速率等于NH3 分解的反应速率 |
| C、H2、NH3的体积分数相等 |
| D、N2、H2、NH3的物质的量浓度相等 |
要除去FeCl3溶液中的FeCl2杂质,采用的方法是( )
| A、加入足量的镁粉 |
| B、通入Cl2气 |
| C、加入足量的铜粉 |
| D、加入足量的Fe粉 |
 某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.
某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2. 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.