题目内容
现取有机物R3.00g与4.48L(标准状况)氧气在密闭容器中燃烧,燃烧后产物只有二氧化碳,一氧化碳和水蒸气(没有反应物剩余),将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重3.60g,碱石灰增重4.40g.
(1)该有机物R分子式为 ;
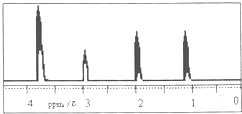
(2)R的核磁共振氢谱如图,则R的结构简式为 .

(1)该有机物R分子式为
(2)R的核磁共振氢谱如图,则R的结构简式为
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:浓硫酸增重3.6g为水的质量,碱石灰增重4.4g为二氧化碳的质量,根据n=
计算二氧化碳、水的物质的量,根据n=
计算氧气的物质的量,根据质量守恒计算CO的质量,进而计算CO的物质的量,根据原子守恒计算n(H)、n(C),根据氧原子守恒计算确定R中是否含有氧元素,进而计算确定该物质的最简式,若最简式中H原子已经饱和C的四价结构,则最简式即为其分子式,由核磁共振氢谱可知,R分子中含有4种氢原子,结合分子式确定其结构简式.
| m |
| M |
| V |
| Vm |
解答:
解:(1)浓硫酸增重3.6g为水的质量,n(H2O)=
=0.2mol,
碱石灰增重4.4g为二氧化碳的质量,n(CO2)=
=0.1mol,
4.48L氧气的物质的量=
=0.2mol,氧气的质量=0.2mol×32g/mol=6.4g
故CO的质量=3g+6.4g-3.6g-4.4g=1.4g,故 n(CO)=
=0.05mol,
故3g A中n(H)=2n(H2O)=0.4mol,n(C)=n(CO2)+n(CO)=0.1mol+0.05mol=0.15mol,
3g A中n(O)=2n(CO2)+n(CO)+n(H2O)-2n(O2)=2×0.1 mol+0.05 mol+0.2 mol-2×0.2 mol=0.05mol,
所以,R分子中n(C):n(H):n(O)=0.15:0.4:0.05=3:8:1,
故A的最简式为C3H8O,H原子已经饱和C的四价结构,故A的分子式为C3H8O,
故答案为:C3H8O;
(2)A的分子式为C3H8O,由核磁共振氢谱可知,R分子中含有4种氢原子,则R的结构简式为:CH3CH2CH2OH,故答案为:CH3CH2CH2OH.
| 3.6g |
| 18g/mol |
碱石灰增重4.4g为二氧化碳的质量,n(CO2)=
| 4.4g |
| 44g/mol |
4.48L氧气的物质的量=
| 4.48L |
| 22.4L/mol |
故CO的质量=3g+6.4g-3.6g-4.4g=1.4g,故 n(CO)=
| 1.4g |
| 28g/mol |
故3g A中n(H)=2n(H2O)=0.4mol,n(C)=n(CO2)+n(CO)=0.1mol+0.05mol=0.15mol,
3g A中n(O)=2n(CO2)+n(CO)+n(H2O)-2n(O2)=2×0.1 mol+0.05 mol+0.2 mol-2×0.2 mol=0.05mol,
所以,R分子中n(C):n(H):n(O)=0.15:0.4:0.05=3:8:1,
故A的最简式为C3H8O,H原子已经饱和C的四价结构,故A的分子式为C3H8O,
故答案为:C3H8O;
(2)A的分子式为C3H8O,由核磁共振氢谱可知,R分子中含有4种氢原子,则R的结构简式为:CH3CH2CH2OH,故答案为:CH3CH2CH2OH.
点评:本题考查有机物分子式确定,题目难度不大,从质量守恒的角度计算一氧化碳的质量,注意若有机物最简式中H原子已经饱和C的四价结构,则最简式即为其分子式.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
人体缺乏下列哪种元素会导致贫血( )
| A、铁 | B、钾 | C、钙 | D、钠 |
下列各物质中能将苯酚溶液、苯甲醇、KSCN、NaOH四种无色液体鉴别出来的是( )
| A、碳酸钠溶液 |
| B、FeCl3溶液 |
| C、酚酞溶液 |
| D、稀盐酸 |
下列化学事实及其解释都正确的是( )
| A、升高温度,水的离子积增大,原因是水的电离是吸热的过程 |
| B、因为氧化铝是一种原子晶体,所以氧化铝熔点高 |
| C、将pH均为3的醋酸和盐酸溶液分别稀释10倍后,因醋酸是弱电解质,导致稀释后醋酸溶液的pH值大于盐酸 |
| D、第VIA族元素简单氢化物中,水的沸点较为异常,这是因为水分子间存在较强的共价键 |
 某课外活动小组利用如图所示的装置进行乙醇的催化氧化实验制取乙醛 (试管丙中用水吸收产物),图中铁架台等装置已略去.实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气.请填写下列空白:
某课外活动小组利用如图所示的装置进行乙醇的催化氧化实验制取乙醛 (试管丙中用水吸收产物),图中铁架台等装置已略去.实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气.请填写下列空白: