题目内容
铁是应用最广泛的金属,铁的卤化物、氧化物以及含氧酸盐均为重要化合物.
(1)在实验室中,FeCl2可用铁粉和 反应制备;
(2)Fe与过量稀硫酸反应可以制取FeSO4.若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是 (填序号).
a.Cl2 b.Fe c.H2O2 d.HNO3
(3)某氧化铁样品中含有少量的FeCl2杂质.现要测定其中铁元素的质量分数,按以下步骤进行实验:
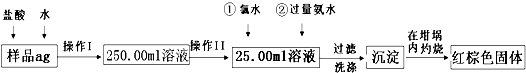
请根据图的流程,回答下列问题:
①操作Ⅰ的目的为配制250.00ml样品溶液,则所用到玻璃仪器除烧杯、玻璃棒、胶头滴管以外,还必须有 (填仪器名称);操作II必须用到的仪器是 .(填字母)
A.50ml烧杯 B.50ml量筒 C.100ml量筒 D.25ml滴定管
②再加入氨水的离子方程式为 .
③检验沉淀是否洗涤干净的操作是 .
④将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3,则接下来还应进行的操作是 .
⑤若坩埚的质量为W1g,坩埚与加热后固体的总质量为W2g,则样品中铁元素的质量分数是 .
⑥有学生认为上述实验步骤太繁琐,他认为,将样品溶于水后充分搅拌,在空气中加热蒸干、灼烧、称量即可,请你评价是否可行? .(填“可行”或“不可行”)
(1)在实验室中,FeCl2可用铁粉和
(2)Fe与过量稀硫酸反应可以制取FeSO4.若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是
a.Cl2 b.Fe c.H2O2 d.HNO3
(3)某氧化铁样品中含有少量的FeCl2杂质.现要测定其中铁元素的质量分数,按以下步骤进行实验:

请根据图的流程,回答下列问题:
①操作Ⅰ的目的为配制250.00ml样品溶液,则所用到玻璃仪器除烧杯、玻璃棒、胶头滴管以外,还必须有
A.50ml烧杯 B.50ml量筒 C.100ml量筒 D.25ml滴定管
②再加入氨水的离子方程式为
③检验沉淀是否洗涤干净的操作是
④将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3,则接下来还应进行的操作是
⑤若坩埚的质量为W1g,坩埚与加热后固体的总质量为W2g,则样品中铁元素的质量分数是
⑥有学生认为上述实验步骤太繁琐,他认为,将样品溶于水后充分搅拌,在空气中加热蒸干、灼烧、称量即可,请你评价是否可行?
考点:探究物质的组成或测量物质的含量,铁盐和亚铁盐的相互转变
专题:
分析:本实验目的是测定铁的质量分数,采取的方法是使样品溶解、反应、最终生成氧化铁,然后通过氧化铁质量来求铁的质量分数.
(1)实验室中,常用铁粉与盐酸反应制备FeCl2;
(2)将Fe2+转化为Fe3+,要求产物纯净,不能引入杂质;
(3)①由图可知,操作I是将加入盐酸反应的溶液稀释成250.00mL溶液,故需要250mL的容量瓶;操作II是准确量取25.00mL的稀释后的溶液,故应需要滴定管;
②加氯水就是让+2价铁变为+3价,加氨水就是使+3价铁充分转化为Fe(OH)3沉淀;
③沉淀洗涤就是把Cl-或NH4+洗掉,可以检验洗涤液中是否含有Cl-,取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净;
④两次连续称量的质量相差不能超过0.1g才能说明分解完全,故应继续加热并称量;
⑤加热分解所得的物质是Fe2O3,其质量为(W2-W1)g,由于去25mL溶液,故250mL溶液可以得到Fe2O3质量为10(W2-W1)g,根据化学式计算铁元素的质量,再利用质量分数的定义计算原氧化铁样品中铁元素的质量分数;
⑥样品溶于水,存在平衡Fe2++2H2O?Fe(OH)2+2H+,加热HCl挥发,促进水解,蒸干加热最终转化为Fe2O3,不影响铁元素质量分数的测定.
(1)实验室中,常用铁粉与盐酸反应制备FeCl2;
(2)将Fe2+转化为Fe3+,要求产物纯净,不能引入杂质;
(3)①由图可知,操作I是将加入盐酸反应的溶液稀释成250.00mL溶液,故需要250mL的容量瓶;操作II是准确量取25.00mL的稀释后的溶液,故应需要滴定管;
②加氯水就是让+2价铁变为+3价,加氨水就是使+3价铁充分转化为Fe(OH)3沉淀;
③沉淀洗涤就是把Cl-或NH4+洗掉,可以检验洗涤液中是否含有Cl-,取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净;
④两次连续称量的质量相差不能超过0.1g才能说明分解完全,故应继续加热并称量;
⑤加热分解所得的物质是Fe2O3,其质量为(W2-W1)g,由于去25mL溶液,故250mL溶液可以得到Fe2O3质量为10(W2-W1)g,根据化学式计算铁元素的质量,再利用质量分数的定义计算原氧化铁样品中铁元素的质量分数;
⑥样品溶于水,存在平衡Fe2++2H2O?Fe(OH)2+2H+,加热HCl挥发,促进水解,蒸干加热最终转化为Fe2O3,不影响铁元素质量分数的测定.
解答:
解:本实验目的是测定铁的质量分数,采取的方法是使样品溶解、反应、最终生成氧化铁,然后通过氧化铁质量来求铁的质量分数.
(1)实验室中,常用铁粉与盐酸反应制备FeCl2;故答案为:盐酸;
(2)将Fe2+氧化为Fe3+,要求产物纯净,不能引入杂质,可以选择双氧水,故答案为:c;
(3)①由图可知,操作I是将加入盐酸反应的溶液稀释成250.00mL溶液,故需要250mL容量瓶;操作II是准确量取25.00mL的稀释后的溶液,故应需要滴定管,
故答案为:250mL容量瓶;D;
②加氨水就是使+3价铁充分转化为Fe(OH)3沉淀,发生反应为Fe3++3NH3H2O=Fe(OH)3↓+3NH4+,
故答案为:Fe3++3NH3H2O=Fe(OH)3↓+3NH4+;
②沉淀洗涤就是把Cl-或NH4+洗掉,可以检验洗涤液中是否含有Cl-,取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净,
故答案为:取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净;
④两次连续称量的质量相差不能超过0.1g才能说明分解完全,故应继续加热并称量,
故答案为:继续加热,冷却至室温时,称量,直至两次连续称量质量差不超过0.1g;
⑤250mL溶液可以得到Fe2O3质量为10(W2-W1)g,铁元素的质量为10(W2-W1)g×
=7(W2-W1)g,所以原氧化铁样品中铁元素的质量分数
,
故答案为:
;
⑥样品溶于水,存在平衡Fe2++2H2O?Fe(OH)2+2H+,加热HCl挥发,促进水解,蒸干加热最终转化为Fe2O3,不影响铁元素质量分数的测定,故该方案可行,
故答案为:可行.
(1)实验室中,常用铁粉与盐酸反应制备FeCl2;故答案为:盐酸;
(2)将Fe2+氧化为Fe3+,要求产物纯净,不能引入杂质,可以选择双氧水,故答案为:c;
(3)①由图可知,操作I是将加入盐酸反应的溶液稀释成250.00mL溶液,故需要250mL容量瓶;操作II是准确量取25.00mL的稀释后的溶液,故应需要滴定管,
故答案为:250mL容量瓶;D;
②加氨水就是使+3价铁充分转化为Fe(OH)3沉淀,发生反应为Fe3++3NH3H2O=Fe(OH)3↓+3NH4+,
故答案为:Fe3++3NH3H2O=Fe(OH)3↓+3NH4+;
②沉淀洗涤就是把Cl-或NH4+洗掉,可以检验洗涤液中是否含有Cl-,取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净,
故答案为:取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净;
④两次连续称量的质量相差不能超过0.1g才能说明分解完全,故应继续加热并称量,
故答案为:继续加热,冷却至室温时,称量,直至两次连续称量质量差不超过0.1g;
⑤250mL溶液可以得到Fe2O3质量为10(W2-W1)g,铁元素的质量为10(W2-W1)g×
| 112 |
| 160 |
| 7(W2-W1) |
| a |
故答案为:
| 7(W2-W1) |
| a |
⑥样品溶于水,存在平衡Fe2++2H2O?Fe(OH)2+2H+,加热HCl挥发,促进水解,蒸干加热最终转化为Fe2O3,不影响铁元素质量分数的测定,故该方案可行,
故答案为:可行.
点评:本题考查溶液配制、离子检验、对实验操作的理解与实验方案的评价、化学计算等,难度中等,清楚测定原理是解题的关键,是对所学知识的综合运用,需要学生具有扎实的基础与运用知识分析解决问题的能力.

练习册系列答案
相关题目
在下列溶液中一定能大量共存的离子组是( )
| A、pH=14的溶液:Na+、AlO2-、CO32- |
| B、pH=1的溶液:Fe2+、Mg2+、NO3- |
| C、含Fe3+的溶液:NH4+、HCO3-、Cl- |
| D、由水电离出的c(H+)=1×10-13mol/L溶液:S2-、K+、Cl- |
关于水在人体中的作用叙述不正确的是( )
| A、将氧气运输到血液 |
| B、将体内代谢的废物通过尿液或粪便排出体外 |
| C、营养素的消化、吸收过程不需要水的作用 |
| D、通过蒸发或出汗来调节体温保持不变 |
 )是一种天然抗癌药物,在一定条件下能发生如下转化:
)是一种天然抗癌药物,在一定条件下能发生如下转化:

 某纯碱样品中含有少量氯化钠杂质,为了测定此样品纯度,甲同学设计了如图所示装置和实验方案.实验步骤如下:
某纯碱样品中含有少量氯化钠杂质,为了测定此样品纯度,甲同学设计了如图所示装置和实验方案.实验步骤如下: