题目内容
12.高锰酸钾可用于生活消毒,是中学化学常见的氧化剂.工业上,用软锰矿制高锰酸钾的流程如图: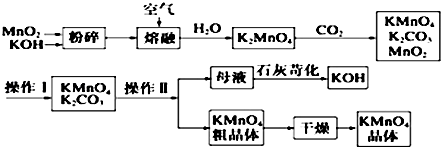
请回答下列问题:
(1)该生产中需要纯净的CO2气体.写出实验室制取CO2的化学方程式CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)KMnO4稀溶液是一种常用的消毒剂.其消毒原理与下列物质相同的是bd(填字母).
a.75%酒精 b.双氧水 c.苯酚 d. 84消毒液(NaClO溶液)
(3)写出二氧化锰和氢氧化钾熔融物中通入空气时发生的主要化学反应的方程式:2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(4)上述流程中可以循环使用的物质有KOH、MnO2(写化学式).
(5)测定高锰酸钾样品纯度采用硫酸锰滴定:向高锰酸钾溶液中滴加硫酸锰溶液,产生黑色沉淀.当溶液由紫红色刚好褪色且半分钟不恢复,表明达到滴定终点.写出该反应的离子方程式:2MnO4-+3Mn2++2H2O═5MnO2↓+4H+.
(6)已知:常温下,Ksp[Mn(OH)2]=2.4×10-13.工业上,调节pH可以沉淀废水中Mn2+,当pH=10时,溶液中c(Mn2+)=2.4×10-5mol/L.
(7)操作Ⅰ的名称是过滤;操作Ⅱ根据KMnO4和K2CO3两物质在溶解性上的差异,采用浓缩结晶(填操作步骤)、趁热过滤得到KMnO4粗晶体.
分析 将MnO2和KOH粉碎,目的是增大反应物的接触面积,加快反应速率,然后将混合物熔融并通入空气,根据流程图知,二者反应生成K2MnO4,根据元素守恒知还生成H2O,K2MnO4和CO2反应生成KMnO4、K2CO3、MnO2,KMnO4、K2CO3易溶于水而MnO2难溶于水,将KMnO4、K2CO3、MnO2溶于水然后过滤得到KMnO4、K2CO3混合溶液,再根据KMnO4、K2CO3溶解度差异采用浓缩结晶、趁热过滤得到KMnO4粗晶体,母液中含有K2CO3,加入CaO,发生反应K2CO3+CaO+H2O=CaCO3↓+2KOH,从而得到KOH,
(1)实验室利用碳酸钙与盐酸反应制二氧化碳;
(2)KMnO4有强氧化性,消毒原理与84消毒液、双氧水一样;
(3)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水.反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为-2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数,根据钾元素守恒确定KOH系数,根据氢元素守恒确定H2O系数;
(4)制备中利用的原料,在转化过程中又生成的可以循环利用,根据流程图可知循环的物质;
(5)向高锰酸钾溶液中滴加硫酸锰溶液,产生黑色沉淀二氧化锰,根据元素守恒和电荷守恒书写离子方程式;
(6)根据Ksp[Mn(OH)2]=c(Mn2+)•c2(OH-),可计算出c(Mn2-);
(7)将KMnO4、K2CO3、MnO2溶于水然后过滤得到KMnO4、K2CO3混合溶液,再根据KMnO4、K2CO3溶解度差异采用浓缩结晶、趁热过滤得到KMnO4粗晶体.
解答 解:(1)实验室利用碳酸钙与盐酸反应制二氧化碳,反应的方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑,
故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)KMnO4有强氧化性,利用其强氧化性杀菌消毒,消毒原理与84消毒液、双氧水一样,故选:bd,
故答案为:bd;
(3)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水.反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为-2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数为2,根据钾元素守恒确定KOH系数为4,根据氢元素守恒确定H2O系数为2,所以反应化学方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O,
故答案为:2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O;
(3)由工艺流程转化关系可知,向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2,反应只有Mn元素的化合价发生变化,由+6价降低为+4价,由+6价升高为+7价,所以K2MnO4既是氧化剂又是还原剂,故答案为;K2MnO4;
(4)制备中利用的原料,在转化过程中又生成的可以循环利用.由转化关系图知,除石灰、二氧化碳外,K2MnO4溶液中通入CO2以制备KMnO4生成的MnO2及最后由母液加入石灰生成的KOH,会在MnO2、KOH的熔融制备K2MnO4中被循环利用,
故答案为:KOH;MnO2;
(5)向高锰酸钾溶液中滴加硫酸锰溶液,产生黑色沉淀二氧化锰,反应的离子方程式为2MnO4-+3Mn2++2H2O═5MnO2↓+4H+,
故答案为:2MnO4-+3Mn2++2H2O═5MnO2↓+4H+;
(6)当pH=10时,c2(OH-),c(OH-)=1×10-4 mol/L,根据Ksp[Mn(OH)2]=c(Mn2+)•c2(OH-),可知c(Mn2-)=$\frac{Ksp[Mn(OH)_{2}]}{{c}^{2}(O{H}^{-})}$=$\frac{2.4×1{0}^{-13}}{(1÷1{0}^{-4})^{2}}$=2.4×10-5mol/L,
故答案为:2.4×10-5mol/L;
(7)将KMnO4、K2CO3、MnO2溶于水然后过滤得到KMnO4、K2CO3混合溶液,所以操作Ⅰ为过滤,再根据KMnO4、K2CO3溶解度差异采用浓缩结晶、趁热过滤得到KMnO4粗晶体,
故答案为:过滤; 浓缩结晶.
点评 本题考查常见氧化剂与还原剂、氧化还原反应、化学计算和对工艺流程的理解、阅读题目获取信息的能力等,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.

已知:
CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O
CH3CH2OH$→_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O
相关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
| 密度(g/mL) | 0.79 | 2.18 | 0.71 | 3.10 |
| 沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
| 熔点/℃ | -114.3 | 9.79 | -116.2 | -7.2 |
| 水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
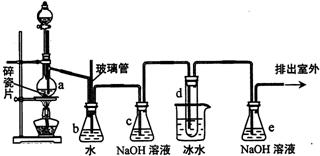
(2)安全瓶b在实验中有多重作用.其一可以检查实验进行中导管d是否发生堵塞,请写出发生堵塞时瓶b中的现象玻璃管中的液面上升,锥形瓶中的液面下降;
安全瓶b还可以起到的作用是防止倒吸.
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是吸收乙烯气体中含有的CO2、SO2等酸性气体.
(4)除去产物中少量未反应的Br2后,还含有的主要杂质为乙醚,要进一步提纯,下列操作中必须的是D(填入正确选项前的字母);
A.重结晶 B.过滤 C.萃取 D.蒸馏
(5)实验中也可以撤去d装置中盛冰水的烧杯,改为将冷水直接加入到d装置的试管内,则此时冷水除了能起到冷却1,2一二溴乙烷的作用外,还可以起到的作用是液封Br2及1,2-二溴乙烷.
| 实验 | 温度/℃ | 起始时 | 平衡时 | |||
| n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
| 1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
| 2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
| 3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
| A. | 上述反应是吸热反应 | |
| B. | 实验1 达平衡时,CO 的转化率为70% | |
| C. | 实验2 达平衡时,a<7.0 | |
| D. | 实验3 达平衡后,再充入1.0molH2,K 值增大,平衡逆向移动 |
| A. | 过滤时,慢慢地将液体直接倒入过滤器中 | |
| B. | 在食盐溶液蒸发结晶的过程中,当蒸发皿中出现较多量固体时即停止加热 | |
| C. | 酒精灯不慎碰倒起火时可用水扑灭 | |
| D. | 先在天平两个托盘上各放一张相同质量的纸,再把NaOH固体放在纸上称量 |
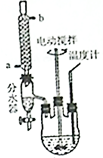 某学习小组以乙二酸(分子式:H2C2O4,结构简式:HOOC-COOH,二元弱酸,俗称草酸)和乙醇为原料制备乙二酸二乙酯,实验步骤如下:
某学习小组以乙二酸(分子式:H2C2O4,结构简式:HOOC-COOH,二元弱酸,俗称草酸)和乙醇为原料制备乙二酸二乙酯,实验步骤如下: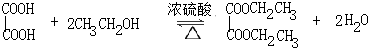 .
. 一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
一定条件下,通过下列反应可实现燃煤烟气中硫的回收: